

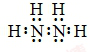 ;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-
;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-分析 (1)N2H4是氮原子和氢原子形成四个共价键,氮原子和氮原子间形成一个共价键形成的共价化合物,N2H4是二元弱碱,结合氨气在溶液中的电离特点可知第一步电离出N2H5+、OH-,据此写出联氨第一步电离方程式;
(2)①根据仪器构造可得;
②KMnO4和浓盐酸反应生成氯化锰和氯气;
(3)①三颈烧瓶所盛溶液中为尿素;
②N2H4•H2O和NaClO发生反应,产物之一是无色无味、性质稳定的单质气体,说明生成氮气,氮元素化合价升高,则氯元素化合价降低生成氯化钠,据此书写;
③由N2H4•H2O+2I2=N2↑+4HI+H2O,用淀粉作指示剂,达到滴定终点时的现象为当滴入最后一滴I2溶液时,溶液有无色变成蓝色,且半分钟内不褪色;根据方程知水合肼的物质的量,进而计算其质量分数.
解答 解:(1)肼的分子式为N2H4,是氮原子和氢原子形成四个共价键,氮原子和氮原子之间形成一个共价键形成的共价化合物,其电子式为: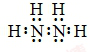 ,联氨为二元弱碱,在水中的电离方式与氨相似,其第一步电离出N2H5+、OH-,联氨第一步电离方程式为:N2H4+H2O?N2H5++OH-;
,联氨为二元弱碱,在水中的电离方式与氨相似,其第一步电离出N2H5+、OH-,联氨第一步电离方程式为:N2H4+H2O?N2H5++OH-;
故答案为: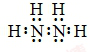 ;N2H4+H2O?N2H5++OH-;
;N2H4+H2O?N2H5++OH-;
(2)①仪器A为蒸馏烧瓶;
故答案为:蒸馏烧瓶;
②KMnO4和浓盐酸反应的离子方程式为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(3)①三颈烧瓶所盛溶液中为尿素,化学式为:CO(NH2)2;
故答案为:CO(NH2)2;
②N2H4•H2O和NaClO发生反应,产物之一是无色无味、性质稳定的单质气体,说明生成氮气,氮元素化合价升高,则氯元素化合价降低生成氯化钠,则化学方程式为:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
故答案为:N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl;
③由N2H4•H2O+2I2=N2↑+4HI+H2O,用淀粉作指示剂,达到滴定终点时的现象为当滴入最后一滴I2溶液时,可知250ml溶液中含有水合肼的物质的量=0.100mol/L×0.036L×$\frac{1}{2}$×$\frac{250}{25}$=0.018mol,水合肼(N2H4•H2O)的质量分数=$\frac{0.018mol×50g/mol}{1g}$=90.0%;
故答案为:当滴入最后一滴I2溶液时,溶液有无色变成蓝色,且半分钟内不褪色;90.0%.
点评 本题考查物质制备实验,涉及物质含量测定、氧化还原反应、方程式的书写、滴定应用等,注意物质性质和题目信息分析,较好的考查学生对实验原理的理解、知识迁移应用,难度中等.


科目:高中化学 来源: 题型:选择题
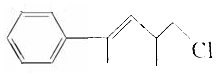 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )| A. | 分子式是C12H15Cl,属于卤代烃 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 既能使溴水褪色,又能使KMnO4 酸性溶液褪色 | |
| D. | 该溶液与酸化的AgNO3 溶液混合时会产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
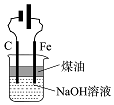
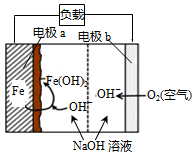 美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H2O═2Fe(OH)2.有关该电池放电时的说法正确的是( )
美国NASA曾开发一种铁-空气二次电池.该电池放电时,其原理如图所示,电池反应为:2Fe+O2+2H2O═2Fe(OH)2.有关该电池放电时的说法正确的是( )| A. | a 极质量不变 | B. | b极为电池负极 | ||
| C. | 电子由a极经负载流向b极 | D. | 由电能转变为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新买的衣服先用水清洗,可除去衣服上残留的有防皱作用的甲醛整理剂 | |
| B. | 硅胶是一种无毒无味,吸附水能力强的物质,常用作袋装食品的干燥剂 | |
| C. | 纤维的应用很广,人造纤维、合成纤维和光导纤维都是有机高分子化合物 | |
| D. | 合金的生成常会改善金属单质的性质,日常生活中合金的使用范围远大于纯金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  |
| A.蒸发氯化铝溶液的AlCl3 | B.分离乙酸钠和乙醇的混合液 | C.检查装置的气密性 | D.制备Fe(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
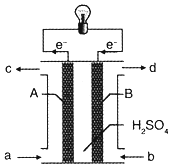 “长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A. | A为正极 | |
| B. | 电池工作时H+由A极向B极迁移 | |
| C. | 从b 口通入四氧化二氮气体且在B极发生氧化反应 | |
| D. | A极发生的电极反应式:C2H8N2+4H2O+16e-═2CO2+N2+16H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )
脑白金又名褪黑激素,据报道它几有提高免疫力.促进睡眠等功能.其结构简式为:下列有关脑白金说法不正确的是( )| A. | 能发生加成反应 | B. | 属于芳香族化合物 | ||
| C. | 分子式为C13H16N2O2 | D. | 不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com