
醛类是有机合成中的重要原料,特别是对有机物碳链增长起着重要的桥梁作用。
如醛类在一定条件下有如下反应:
CH3CHO+Br—CH—COOC2H5CH3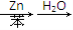 CH3—CH—CH—COOC2H5OHCH3
CH3—CH—CH—COOC2H5OHCH3
用CH3—CH—COOHOH通过以下路线可合成(G):
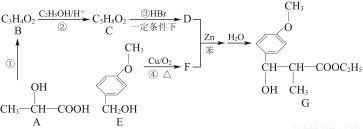
(1)反应①的条件是 。
(2)B的结构简式为 ,其核磁共振氢谱显示分子内有3种不同环境的氢原子,其个数比为 。
(3)反应②和④的类型是 、 。
(4)D与足量的热NaOH溶液反应的化学方程式为 。
(5)F的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物W,W的结构简式为 。
(1)浓硫酸、加热
(2)CH2=CH—COOH 2∶1∶1
(3)酯化反应 氧化反应
(4)CH3—CH—COOC2H5Br+2NaOH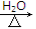 CH3—CH—COONaOH+C2H5OH+NaBr
CH3—CH—COONaOH+C2H5OH+NaBr
或Br—CH—COOC2H5CH3+2H2O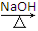 CH3—CH—COOHOH+C2H5OH+HBr
CH3—CH—COOHOH+C2H5OH+HBr
(5)CH2OH
【解析】分析框图可知A发生羟基的消去反应,生成B,B为丙烯酸,B→C为丙烯酸与乙醇的酯化反应,生成C为丙烯酸乙醇酯,而C→D为双键的加成反应,生成D的结构简式为Br—CH—COOC2H5CH3;由E→F的反应条件看出,为醇羟基的催化氧化,生成的F的结构简式为OCH3CHO,迁移题中信息可知,D和F反应生成产物G。(5)F的同分异构体能发生银镜反应,且能水解,则必含有甲酸的酯结构,根据F的结构简式可知其同分异构体为甲酸苯甲酯,则其水解产物W为苯甲醇。


科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
下列叙述正确的是( )
A.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大
C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等
D.在NaHCO3溶液中:c(OH-)+c(CO32—)=c(H+)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:填空题
化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能: H—H键键能为Q1 kJ·mol-1、H—O键键能为Q3 kJ·mol-1、O2分子内氧原子间的键能为Q2 kJ·mol-1。
(1)请根据上述数据,在图中标注的数字处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量。
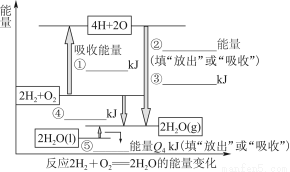
(2)请写出1 molH2燃烧生成液态水的热化学反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列有关离子反应或离子方程式的叙述中,正确的是( )
A.能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
B.惰性电极电解氯化铝溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.镁与极稀硝酸反应生成硝酸铵的离子方程式为4Mg+6H++NO3—=4Mg2++NH4++3H2O
D.将10 mL 0.1 mol·L-1 KAl(SO4)2溶液和10 mL 0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.能溶解Al2O3的溶液:Na+、K+、HCO3—、NO3—
B.0.1 mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl-
C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3—
D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题17有机化学基础练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.纤维素属于髙分子化合物,与淀粉互为同分异构体,水解后均生成葡萄糖
B.某有机物结构如图所示,该有机物属于芳香族化合物的同分异构体有5种,其中遇FeCl3溶液能显色的有3种
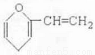
C.5个碳原子的有机物,每个分子中最多可形成4个碳碳单键
D.2,3?二甲基丁烷的H—NMR上有5个峰
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.金刚石、碳化硅、晶体硅的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,每个CaO晶胞中含有4个Ca2+和4个O2-
C.设NaCl的摩尔质量为M g·mol-1,NaCl的密度为ρ g·cm-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为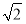 ·
·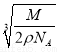 cm
cm
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的组成式为XY3
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:实验题
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由 (用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有 _;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下:
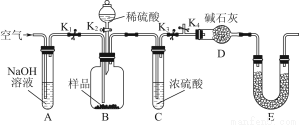
①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 _ 、洗涤、干燥;
②装置E中药品的名称是 __作用为 __;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是 ;
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是 _,关闭的是 _。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为 _
若假设三成立,则Cu(OH)2的质量分数为 _;若不进行步骤c,则会使测得结果 (填“偏高”“无影响”“偏低”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
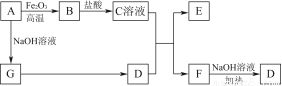
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”)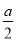 mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com