
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 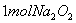 固体中含离子总数为
固体中含离子总数为
B. 常温下,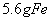 与足量稀
与足量稀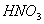 反应,转移
反应,转移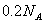 个电子
个电子
C. 常温常压下,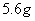 乙烯与丁烯的混合物中含有的氢原子的数目为
乙烯与丁烯的混合物中含有的氢原子的数目为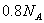
D. 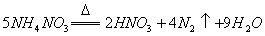 反应中,生成
反应中,生成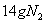 时,转移的电子数目为
时,转移的电子数目为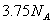
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
下列浓度关系正确的是
A. 氯水中:c(Cl2)=2[c(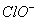 )+c(
)+c(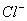 )+C(HClO)]
)+C(HClO)]
B. 氯水中:c(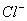 )>c(
)>c(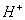 )>c(
)>c(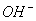 )>c(
)>c(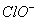 )
)
C. 等体积等浓度的氢氧化钠与醋酸混合:c(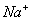 )=c(
)=c(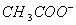 )
)
D. 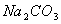 溶液中:c
溶液中:c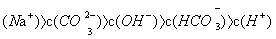
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
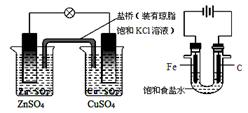
① ② ③ ④
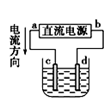
A.图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
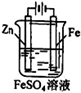
B.图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C.用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
D.用装置④可进行铁片镀锌
查看答案和解析>>
科目:高中化学 来源: 题型:
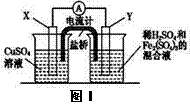 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐。现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,铜片完全溶解。
(1)写出铜溶于上述混合溶液的离子方程式 。
(2)若在如图Ⅰ所示的装置中发生(1)中的反应,则X极是
(“正极”或“负极”),电极反应式是
(3)铜完全溶解时,所得溶液中Fe3+、Cu2+、H+三种阳离子的浓
度均为0.2 mol/L(假设溶液体积不变),若用电解方法回收铜,
 装置如图Ⅱ所示。
装置如图Ⅱ所示。
①电解开始阶段,阳极的电极反应式为 ,
阴极的电极反应式为 。
②判断溶液中的Cu2+已完全析出的现象是 。
当Cu2+恰好完全析出时,转移电子的物质的量 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素。已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个单电子,G的核电荷数比F多5。请回答下列问题(用相应的元素符号、化学式和化学术语填空)
(1)G在周期表中的位置是__________,F元素的原子基态价层电子排布式为__________。
(2)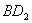 分子的电子式为__________,
分子的电子式为__________,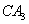 分子的空间立体构型为__________。
分子的空间立体构型为__________。
(3)A元素分别与B、D元素形成的两种微粒H、I都具有N2H4相似的结构,属于等电子数微粒,它们的化学式分别是H:__________、I:__________。
(4)向G的硫酸盐溶液中逐滴加入足量的氨水至得到的沉淀完全溶解,再向该溶液中加入一定量乙醇,析出一种深蓝色晶体。在该晶体中存在的化学键的种类有__________。
(5)0.3g H在足量氧气中燃烧,生成气态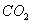 和液态
和液态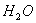 ,放出Q kJ热量,则表示H的燃烧热的热化学方程式为____________________。某燃料电池用H作燃料,KOH为电解液,该电池的负极电极反应式为:________________________________________。
,放出Q kJ热量,则表示H的燃烧热的热化学方程式为____________________。某燃料电池用H作燃料,KOH为电解液,该电池的负极电极反应式为:________________________________________。
(6)G的一种氧化物的晶胞结构如图所示(黑球代表G原子),该氧化物的化学式为____________________。
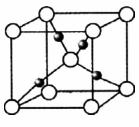
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴已知4NH3(g)+5O2(g)=4NO(g) +6H2O(l),△H=x kJ/mol。蒸发1mol 液态水需要吸收的能量为44kJ,其它相关数据如下表:
| NH3(g) | O2(g) | NO(g) | H2O(g) | |
| 1mol分子断裂化学键时需要吸收的能量/kJ | a | b | z | d |
则表中z(用x、a、b、d表示)的大小为______________________________________________
⑵已知a g 乙烯气体充分燃烧时生成1molCO2和液态水,放出b k J的热量,则乙烯燃烧热的热化学方程式为________________________________________________。
⑶利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可以制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
⑷肼(N2H4)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+,下列说法正确的是( )
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com