
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 。
(2)Y元素原子的电子排布图为 ,元素X与Y的电负性比较:X Y(填“>”或“<”)。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 。
(4)由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构如图所示。(黑球位于立方体内,白球位于立方体顶点和面心)
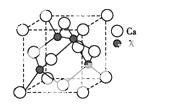
请写出化合物A的化学式 ;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为 。
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为 。
科目:高中化学 来源: 题型:
正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)互为同分异构体; 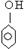 与
与  互为同系物
互为同系物
B.金刚石、CH4、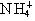 粒子的空间构型均为正四面体;晶体硅、碳化硅均为原子晶体
粒子的空间构型均为正四面体;晶体硅、碳化硅均为原子晶体
C.16O与18O互为同位素;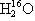 、
、 、
、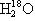 、
、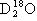 互为同素异形体
互为同素异形体
D.Ca2+的结构示意图为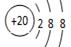 ,NH4CI的电子式为
,NH4CI的电子式为
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氯化铝的熔点为190 ℃(2.02×106 Pa),但它在180 ℃即开始升华。
(1)氯化铝是________(填“离子晶体”或“分子晶体”)。
(2)在500 K和1.01×105 Pa时,它的蒸气密度(换算成标准状况时)为11.92 g·L-1,试确定氯化铝在蒸气状态的化学式为________,微粒间的作用力类型有________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判断氯化铝是离子晶体还是分子晶体,你设计的实验是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。
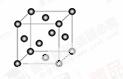
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、M、D、E是原子序数依次增大的五种短周期元素。A元素的一种原子中不含中子。B、M、D、E分别在下表(周期表的一部分)不同的空格内占有相应的位置,E的原子序数是D的原子序数的2倍。试回答:
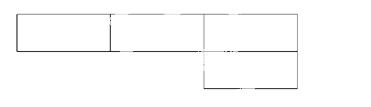
(1)将D、E的元素符号分别填在相应的空格内。
(2)在B、M、D、E四种元素的最简单氢化物中,沸点最高的是__________(填化学式)B、M的最简单氢化物的空间构型分别为________、____ ____。
____。
(3)A、B、M、D可组成多种18电子分子,其中两种的结构可分别表示为A2M—MA2和BA3—MA2,请根据这两种分子的结构特点再写出2种具有18电子的有机物的结构简式__________、__________(用元素符号表示)。
(4)D 存在于人体中,能使人过早衰老,但在催化剂存在下很快转化为A2D2、D2等物质,该转化过程可用离子方程式表示为______+______H2O
存在于人体中,能使人过早衰老,但在催化剂存在下很快转化为A2D2、D2等物质,该转化过程可用离子方程式表示为______+______H2O ______+________+______,其中A2D2中所含化学键类型有________。
______+________+______,其中A2D2中所含化学键类型有________。
(5)由C原子构成C60,其晶体类型为________,由M最高价氧化物与其气态氢化物反应生成的物质为________,其晶体类型为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________________________(用对应的元素符号表示);基态D原子的电子排布式为
______________________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。
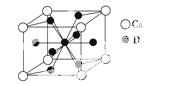
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)环境专家认为可以用金属铝将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,写出反应的离子方程式 。
、N2,写出反应的离子方程式 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3。电池正极的电极反应式为 。
(3)已知:①4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
②Fe2O3(s)+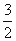 C(s)=
C(s)= 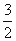 CO2(g)+2Fe(s) △H=+234.1kJ/mol
CO2(g)+2Fe(s) △H=+234.1kJ/mol
③C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图: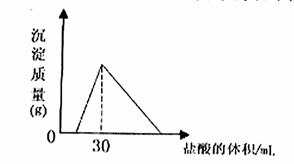 则反应过程中产生氢气的总体积为 L(标准状况)
则反应过程中产生氢气的总体积为 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值 ,下列说法正确的是
,下列说法正确的是
A.常温常压下,8gO2含有4nA个电子
B.1L0.1mol•L-1的氨水中有nA个NH4+
C.标准状况下,22.4L盐酸含有nA个HCl分子
D.1molNa被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com