
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化 | |
| C. | 化学反应速率的大小主要取决于反应物的本身性质 | |
| D. | CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下不能自发进行 |
分析 A.化学反应的实质是原子的重新组合,原子的种类和数目没有发生变化,但分子的种类一定发生变化;
B.化学反应的实质是旧化学键断裂,新化学键的生成,过程中有能量变化;
C.化学反应速率主要取决于物质本性;
D.根据△G=△H-T•△S<0自发判断.
解答 解:A.化学反应过程是旧键的断裂与新键的形成过程,是原子间重新组合的过程,原子的种类和数目没有发生变化,但分子的种类一定发生变化,而分子的数目可能改变也可能不变,故A错误;
B.化学反应涉及化学键的断裂和生成,旧化学键断裂吸收热量,新化学键的生成是放热过程,反应前后一定伴随着能量的变化,故B正确;
C.化学反应速率的大小主要取决于反应物的性质,外界条件也可以影响反应速率,故C正确;
D.CO2(g)+C(s)?2CO(g)属于吸热反应,△H>0,固体分解得到气体,混乱度增加,△S>0,在高温条件下△G=△H-T•△S<0反应能进行,反应常温下不能自发进行,故D正确.
故选A.
点评 本题考查了能量变化的过程分析判断,化学反应的实质理解是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
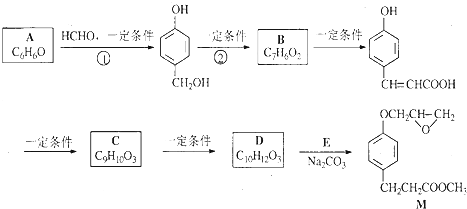
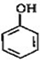 B
B C
C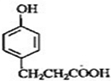
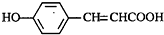 的邻位异构体分子内脱水的反应方程式
的邻位异构体分子内脱水的反应方程式 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.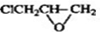 ,写出由D生成M的化学反应方程式
,写出由D生成M的化学反应方程式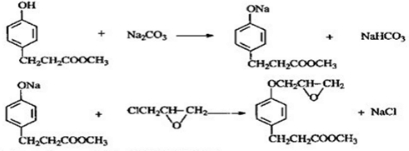 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H | B. | F | C. | Na | D. | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag2O与CuCl反应的化学方程式为Ag2O+2CuCl═2AgCl+Cu2O | |
| B. | Ag2O溶于稀硝酸的离子方程式为Ag2O+2H+═2Ag++H2O | |
| C. | CuCl可以用铜在氯气中燃烧来制备 | |
| D. | 可以用稀硝酸来鉴别Ag2O与CuCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl(澄清石灰水) | B. | NO2(H2O) | C. | SO2(H2O2溶液) | D. | Cl2(NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42.0g | B. | 21.3g | C. | 7.1g | D. | 3.55g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)已知下热化学方程式:
(1)已知下热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com