
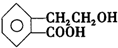 ������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E�������ʣ�
������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E�������ʣ�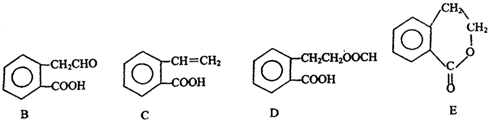
 ��
��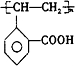 ��
��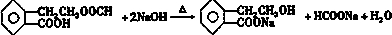 ��
�� ���� ��A�Ľṹ��ʽ��֪��A�����������͵Ĺ����ţ��ǻ����Ȼ�������A�ܷ�����ȥ��Ӧ��A��C����������Ӧ��A��B����������Ӧ��A��E������C����̼̼˫���ܷ����Ӿ۷�Ӧ���Դ˽����⣮
��� �⣺��1��A��C�ķ�ӦΪA������ȥ��Ӧ����C=C�����ŵĹ��̣��ʴ�Ϊ����ȥ��Ӧ��
��2��C��E�ķ���ʽ��ͬ�����ṹ��ͬ����Ϊͬ���칹�壬�ʴ�Ϊ��C��E��
��3��A�к���-HO���ɱ�����Ϊ-CHO����Ӧ�ķ���ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��4��A��B��D��E֮������Ǽ���Ϊ�����幹�ͣ�����������ԭ�ӹ��棬ֻ��B�б�����̼̼˫����-COOH���ʻ�Ϊƽ��ṹ��ֱ�����������������������е�ԭ���п��ܶ���ͬһƽ���������C���ʴ�Ϊ��C��
��5��C�к���C=C���ɷ����Ӿ۷�Ӧ�����ɸ߾���Ϊ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��6��D�к���������ˮ�����ɴ��ͼ��ᣬ�����Ȼ�������NaOH��Ӧ������ʽΪ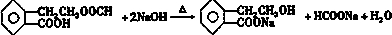 ��
��
�ʴ�Ϊ��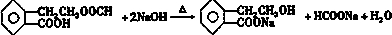 ��
��
���� ���⿼���л���Ľṹ�����ʣ�Ϊ��Ƶ���㣬���չ����������ʡ��л���Ӧ��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע�⣨4��Ϊ�����ѵ㣬��Ŀ�ѶȲ���


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �׳ƾƾ� | B�� | ����������Ʒ�Ӧ | ||
| C�� | �Ҵ����������� | D�� | �������ᷢ��������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȩ��Һ������������ͭ����Һ����CH3CHO+2Cu��OH��2+OH-$\stackrel{��}{��}$CH3COO-+Cu2O��+2H2O | |
| B�� | ������Һ������������ͭ��Ӧ��2H++Cu��OH��2��Cu2++2H2O | |
| C�� | ��������Һ��ͨ������������̼��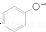 +CO2+H2O$\stackrel{��}{��}$ +CO2+H2O$\stackrel{��}{��}$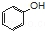 +HCO3- +HCO3- | |
| D�� | ��������������������Һ��Ӧ��CH3COOCH2CH3+OH-��CH3COO-+CH3CH2O-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ��1���£�N2H4���ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϣ���֪��101kPa��25��ʱ��16gN2H4����������ȫȼ�����ɵ������ų�����312kJ��N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ��N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624KJ/mol��
��1���£�N2H4���ֳ���������һ�ֿ�ȼ�Ե�Һ�壬���������ȼ�ϣ���֪��101kPa��25��ʱ��16gN2H4����������ȫȼ�����ɵ������ų�����312kJ��N2H4��ȫȼ�շ�Ӧ���Ȼ�ѧ����ʽ��N2H4��l��+O2��g��=N2��g��+2H2O��l����H=-624KJ/mol���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢ڢ� | C�� | �٢ڢۢ� | D�� | ���϶�����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
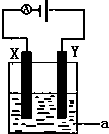 ��1����֪H-H ����Ϊ436kJ•mol-1��H-N������Ϊ391kJ•mol-1�����ݻ�ѧ����ʽ��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1����N��N���ļ�����945.6kJ•mol-1
��1����֪H-H ����Ϊ436kJ•mol-1��H-N������Ϊ391kJ•mol-1�����ݻ�ѧ����ʽ��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1����N��N���ļ�����945.6kJ•mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ľṹʽ��H-Cl-O | B�� | CO2�ı���ģ��  | ||
| C�� | ���������ӵĵ���ʽ��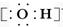 | D�� | NH4Br�ĵ���ʽ��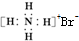 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO+H2O�TCO2+H2 | B�� | 4Fe��OH��2+O2+2H2O�T4Fe��OH��3 | ||
| C�� | 2F2+2H2O�T4HF+O2 | D�� | 2Al+2NaOH+2H2O�T2NaAlO2+3H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com