
【题目】(1)0.5 mol SO2共约含有_____个原子,它与______gSO3所含硫原子数相等。
(2)3.6gNH4+共约含有_____个电子,共约含有_____个中子
(3)质量相同的 ①HCl、②NH3、③CO2、④O2四种气体中,含有分子数目最少的是(填序号)___________________。
(4)有100mL 0.2 mol/L 的NaOH溶液,将此溶液稀释到200 mL,则溶液中Na+的物质的量是__________ 。将稀释后的溶液与300 mL 0.4 mol/L 的NaOH溶液混合后,Na+的物质的量浓度是__________ 。
【答案】1.5NA402NA1.4NA③0.020.28
【解析】
(1)0.5 mol SO2中含有原子的物质的量是0.5mol×3=1.5mol,共含有1.5NA个原子,分子中含有0.5mol硫原子,则含有相同硫原子的三氧化硫的物质的量是0.5mol,其质量是0.5mol×80g/mol=40g。
(2)3.6gNH4+的物质的量是3.6g÷18g/mol=0.2mol,1个铵根含有10个电子、7个中子,则共含有2NA个电子、1.4NA个中子
(3)根据N=m/MNA可知质量相同时气体的摩尔质量越大,分子数目越少。①HCl、②NH3、③CO2、④O2四种气体的摩尔质量分别是(mol/L)36.5、17、44、32,所以含有分子数目最少的是二氧化碳,答案选③。
(4)有100mL 0.2 mol/L的NaOH溶液,将此溶液稀释到200 mL,则根据稀释过程中溶质的物质的量不变可知稀释后溶液中Na+的物质的量是0.1L×0.2mol/L=0.02mol。将稀释后的溶液与300 mL 0.4 mol/L的NaOH溶液混合后,Na+的物质的量浓度是![]() 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照以下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2%H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是______________________。
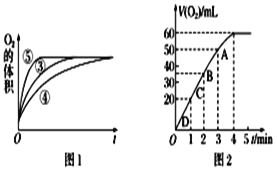
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1。分析图1能够得出的实验结论是(Ⅰ)____________。(Ⅱ)_____________。
(3)加入0.1 g MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示。反应速率逐渐变化的原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次增大的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 常见气态氢化物的稳定性:X<Y<Z
C. 1 mol WM溶于足量水中完全反应,共转移2 mol电子
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组开展下列实验探究活动:
(1)装置A 中反应的化学方程式为___________________________。
(2)利用装置A 中产生的气体设计实验证明+4价硫具有氧化性:___________________________。
(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱。
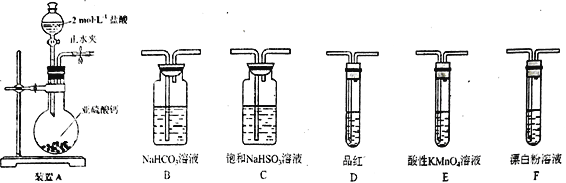
装置连接顺序为___________________________。通过___________________________现象即可证明亚硫酸的酸性强于次氯酸。
(4)利用G装置可测定装置A 液中SO2的含量。量取1.00 mL残液于烧瓶中,加适量的水稀释,加热使SO2全部逸出并与锥形瓶中H2O2完全反应(SO2+H2O2==H2SO4,然后用0.1000 mol/LNaOH 标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL。
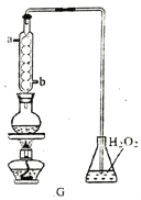
①残液中SO2含量为____________g·L-1
②经多次测定发现,测定值始终高于实验值,则其原因是___________________________。
(5)设计实验证明H2SO3为二元弱酸:___________________________。(可提供的仪器:pH计,其他中学化学常见仪器任选,药品:0.10mol·L-1NaOH溶液、0.05 mol·L-1H2SO3溶液,酸碱指示剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来我国科技发展突飞猛进。下列设备工作时主要由化学能转化为电能的是
A.海上风力发电
B.“深海勇士”号潜水器的新型锂电池
C.北斗导航卫星的太阳能电池板
D.“长征5号”火箭使用的煤油液氧发动机
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.氢氧化钠的摩尔质量是40g
B.1mol氢氧根离子的质量是17g
C.1mol氮的质量是14g/mol
D.氩气的摩尔质量就是它的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
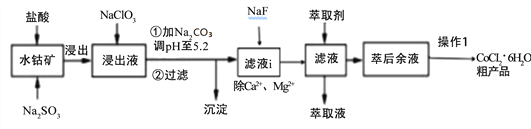
已知:①浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方式_______________________________。
(2)NaClO3的作用是____________________写出该反应的离子方程式_____________;
若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体是 ___________(填化学式)。
(3)加Na2CO3调pH至5.2所得沉淀为________________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图。加萃取剂的目的是_______________;其使用的最佳pH范围是(填字母代号)__________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
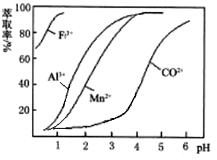
(5)操作I包含3个基本实验操作是蒸发、结晶和过滤.制得的CoCl26H2O需减压烘干的原因是______________________________。
(6)除“钙”“镁”是将滤液i中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
A. NH4+ B. PH3 C. H3O+ D. OF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为某市售盐酸试剂瓶标签上的部分数据。请通过计算回答:

(1)此盐酸的物质的量的浓度为多少?__________
(2)该盐酸50mL与2.5 mol·L-1的NaOH溶液200mL混合,再将混合后溶液稀释至900mL,此时溶液中氢离子的物质的量浓度约为多少?_____________
(3)在标准状况下,1体积水吸收多少体积的HCl气体可制得此盐酸?(保留一位小数,水的密度以1.00g/cm3计)_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com