
【题目】工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如图:
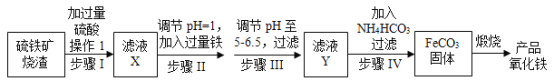
试回答下列问题:
(1)滤液X中含有的金属阳离子是___(填离子符号)。
(2)步骤Ⅱ中发生反应的离子方程式为_____。
(3)步骤Ⅲ中最好可选用___(填字母)调节溶液的pH。
A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液
(4)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是___。
(5)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是______。
(6)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_____。
【答案】Fe3+、Fe2+ Fe+2Fe3+=3Fe2+ B 取少量待测液于试管中,滴加少量K3Fe(CN)6溶液,若产生蓝色沉淀,则含Fe2+ 防止NH4HCO3受热分解 4FeCO3+O2![]() Fe2O3+4CO2
Fe2O3+4CO2
【解析】
硫铁矿烧渣酸浸时,二氧化硅不溶于酸,滤渣为二氧化硅;滤液为硫酸、硫酸铁、硫酸亚铁;加入适量铁粉,铁离子与铁粉反应生成亚铁离子;过滤除去稍过量的铁粉,加入碳酸氢铵产生碳酸亚铁沉淀,在空气中煅烧生成氧化铁;
(1)硫铁矿烧渣中含有氧化铁、氧化亚铁,酸浸时生成硫酸铁和硫酸亚铁,金属阳离子为Fe3+、Fe2+;
(2)步骤Ⅱ中铁粉与Fe3+反应生成Fe2+,离子方程式为Fe+2Fe3+=3Fe2+;
(3)步骤Ⅲ中含有的金属阳离子为Fe2+,调节pH的物质应不具备强氧化性,不引入新的杂质离子,答案为B;
(4)检验Fe2+常用的试剂为K3Fe(CN)6,方法为取少量待测液于试管中,滴加少量K3Fe(CN)6溶液,若产生蓝色沉淀,则含Fe2+;
(5)步骤Ⅳ加入的试剂为NH4HCO3,受热时容易分解,则控制的温度一般为35℃以下;
(6)在空气中煅烧FeCO3时,与空气中的氧气反应生成氧化铁和二氧化碳,方程式为4FeCO3+O2![]() Fe2O3+4CO2。
Fe2O3+4CO2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】四位同学同时进行反应![]() 的速率测定实验,分别测得反应速率如下:
的速率测定实验,分别测得反应速率如下:
①v(A)=0.15mol/(Ls),②v(B)=0.6mol/(Ls),③v(C)=0.4mol/(Ls),④v(D)=0.45mol/(Ls)。其中反应进行得最快的是( )
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ba(NO3)2可用于生产烟花。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用某种钡泥[主要含有BaCO3、Ba(FeO2)2、极少量CuCO3等]制取Ba(NO3)2晶体,其部分工艺流程如下:
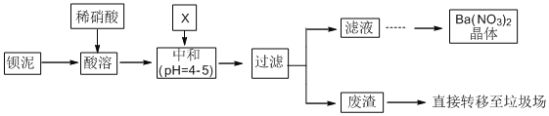
已知:Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7。
(1)酸溶时不使用浓硝酸的原因是_________________________________。
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为__________________。
(3)该厂结合本厂实际,中和选用的X为____________(填化学式);中和使溶液中______(填离子符号)的浓度减少(中和引起的溶液体积变化可忽略)。
(4)滤液得到Ba(NO3)2晶体的操作依次为_________、_________、过滤。
(5)该厂生产的Ba(NO3)2晶体含有少量Cu2+。化学上通过惰性电极电解法富集Cu时,发现电解装置的阴极还有少量使红色石蕊试纸变蓝的气体生成。生成该气体的电极反应为______________________________。
(6)Ba2+致死量为355mg/kg。误食Ba2+可以服用MgSO4溶液解毒,涉及到的离子反应方程式为___________;为了减少环境污染,请对上述流程中不合理的设计进行改进,改进措施是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
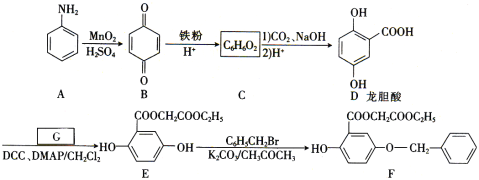
(1)A的分子式是______,B含有的官能团的名称是_________。
(2)D→E的反应类型是_________。
(3)已知G能与金属钠反应,则G的结构简式为________。
(4)写出E→F的化学方程式:_________。
(5)龙胆酸D的同分异构体有多种,符合下列条件的有___种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:____。
①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2mol Na2CO3反应。
(6)已知: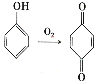 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(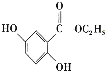 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中HCHO的氧化,其反应如下:HCHO+O2![]() CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A. HCHO含有的官能团为羧基
B. CO2分子是由极性键形成的极性分子
C. HCHO分子中既含σ键又含π键
D. 每生成18 g H2O消耗22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. N2(g)![]() NH3(g)
NH3(g)![]() NH4Cl(aq)
NH4Cl(aq)
B. Fe(s)![]() FeCl2(s)
FeCl2(s)![]() Fe(OH)2(s)
Fe(OH)2(s)
C. MgO(s)![]() MgSO4(aq)
MgSO4(aq)![]() Mg(s)
Mg(s)
D. S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+![]() Fe2++Cr3+。下列说法正确的是( )
Fe2++Cr3+。下列说法正确的是( )
![]()
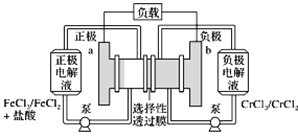
A. 电池放电时,a极的电极反应式为Fe3++3e===Fe
B. 电池放电时,电路中每通过0.1 mol电子,Fe3+浓度降低0.1 mol·L1
C. 电池充电时,Cl从a极穿过选择性透过膜移向b极
D. 电池充电时,b极的电极反应式为Cr3++e===Cr2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应种M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
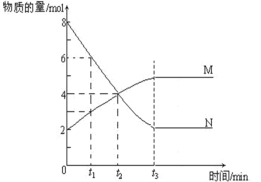
A.t2时,正逆反应速率相等,达到平衡
B.t3时间以后,正反应速率大于逆反应速率
C.t1时N的浓度是M的两倍
D.达到平衡时,N的浓度与M的浓度相等且不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(Na2CO4)是一种很好的供氧剂,其与稀盐酸反应的化学方程式为2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O。市售过碳酸钠一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下两种方案实施:
方案一:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)操作①和③的名称分别为______________________。
(2)上述操作中,使用到玻璃棒的有 _________________(填操作序号)。
(3)请简述操作③的操作过程:________________________________________________。
方案二:按下图所示安装好实验装置,Q为一塑料气袋,随意取适量样品于其中,打开分液漏斗活塞,将稀盐酸滴入气袋中至充分反应。

(4)为测定反应生成气体的总体积,滴稀盐酸前必须关闭______(填“K1”“K2”或“K3”,下同),打开________。导管A的作用是_____________________________________________。
(5)当上述反应停止后,使K1、K3处于关闭状态,K2处于打开状态,再缓缓打开Kl。 B中装的固体试剂是________________________。
(6)实验结束时,量筒Ⅰ中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com