
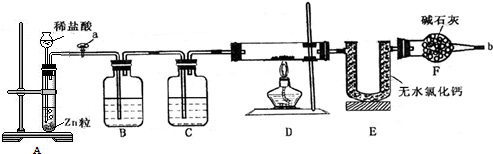
分析 (1)依据装置中气体压强变化和液面变化分析判断装置气密性;
(2)D装置发生的反应是氢气还原氧化亚铁、氧化铁的反应,生成了铁和水;
(3)根据氧化铁、氧化亚铁的总质量及U型管的质量增加7.2g为水的质量列式计算;
(4)若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,氧元素物质的量偏大,Fe2O3的质量也将偏大.
解答 解:(1)检查装置A的气密性,从长颈漏斗口注水,待水从漏斗管上升与容器内的水面形成一段水柱差,停止加水,一段时间后液面不变证明气密性完好;
故答案为:从长颈漏斗口注水,待水从漏斗管上升与容器内的水面形成一段水柱差,停止加水,静置片刻如水柱差不下降,证明其气密性良好;
(2)装置D中发生的是氧化亚铁、氧化铁与氢气的反应,反应方程式为:3H2+Fe2O32Fe+3H2O,H2+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+H2O,
故答案为:3H2+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O,H2+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+H2O;
(3)U型管的质量增加的7.2g是水,物质的量是 $\frac{7.2g}{18g/mol}$=0.4mol,
设FeO、Fe2O3物质的量分别为X、Y,则:X+3Y=0.4
根据质量可列式:72X+160Y=23.2
解得Y=0.1,X=0.1,
所以氧化铁的质量为:160g/mol×0.1mol=16g,
故答案为:16;
(4)干燥管F的作用防空气中水蒸气对实验干扰,若无干燥管F,空气中的水蒸气被E吸收则所测生成水的质量增大,导致氧的含量增大,Fe2O3的质量将偏大,
故答案为:防止空气中的水蒸气等气体进入E中.
点评 本题考查了测定FeO和Fe2O3固体混合物中Fe2O3的质量,是一道综合实验题,解题的关键是掌握各种装置的作用,并能根据相关的数据进行计算,此题对训练学生思维能力有一定帮助,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖与稀H2SO4共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| B. | 淀粉中加入20%H2SO4溶液在沸水浴中加热,使其水解 | |
| C. | 甘氨酸和蛋白质溶液中分别滴加0.1%茚三酮溶液并加热,溶液分别显蓝色和紫色 | |
| D. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | 若2molNa2O2完全反应,则反应中共转移了4mol电子 | |
| C. | 还原剂与氧化剂的质量比是1:1 | |
| D. | Na2O2中阳离子与阴离子的个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
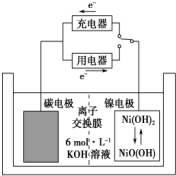 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法中不正确的是( )| A. | 充电时阴极反应:2H2O+2e-═2OH-+H2↑ | |
| B. | 充电时将碳电极与电源的负极相连 | |
| C. | 放电时,OH-移向碳电极 | |
| D. | 放电时镍电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钡不溶于水,所以硫酸钡是非电解质 | |
| B. | 二氧化碳溶于水可以导电,所以,二氧化碳是电解质 | |
| C. | 固态磷酸是电解质,所以磷酸在熔化时或溶于水时都能导电 | |
| D. | 液态氯化氢不能导电,但氯化氢是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com