
【题目】下列反应方程式书写不正确的是
A. 用氢氟酸雕刻玻璃:SiO2+4HF=SiF4↑+2H2O
B. 工业上用电解法制镁:MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
C. 将铝片打磨后放入氢氧化钠溶液中:2Al+2OH﹣=2AlO2-+H2↑
D. 氢氧化亚铁暴露于空气中:4Fe(OH)2 +O2 +2H2O=4Fe(OH)3
科目:高中化学 来源: 题型:
【题目】在生产生活中氮及其化合物的应用和处理已引起广泛关注。
(1)合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。
2NH3(g) ΔH = -92.4 kJ/mol,如下图所示,将6 mol N2和14 mol H2充入一容积可变的密闭容器中发生反应,反应开始时活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示,下列表述能用来判断图2所示状态已达平衡的是________,则该条件下反应的平衡常数为________。

A.活塞不再移动 B.容器内气体压强不再改变
C.容器内气体密度不再改变 D.容器内气体的平均分子质量不再改变
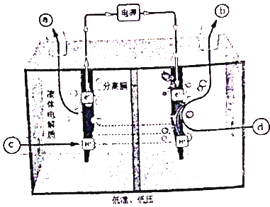
(2)研究者通过探索,发现利用反向燃料电池可以在温和的条件下将电解水制氢与氮、氢反应制氨合并(即将电解产生的活性氢作为中间产物直接还原氮气),其工作原理示意图如下:写出阴极电极方程式________。
(3)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g),
4N2(g)+6H2O(g),
①已知4NH3(g)+ 3O2(g)![]() 2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
2N2(g)+6H2O(g) ΔH1 = -1269.0 kJ/mol;
N2(g)+ O2(g)![]() 2NO(g) ΔH2 = +180.8 kJ/mol
2NO(g) ΔH2 = +180.8 kJ/mol
则反应4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g)的ΔH = ________。
4N2(g)+6H2O(g)的ΔH = ________。
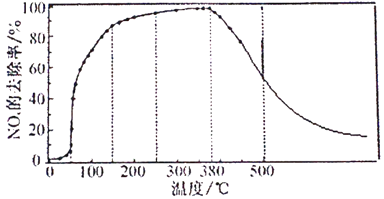
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应容器中反应10时测得NOx的去除率随反应温度的变化曲线如下图所示,请解释当反应温度高于380℃时NOx的去除率随温度升高先迅速下降后缓慢下降的原因________。
③请在下图中画出反应8min时NOx的去除率随温度变化的曲线。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_____________。
(3)试剂②选用________;写出其反应的离子方程式_______。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秋冬季是雾霾高发季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NOX可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_______________________________。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
N2(g)+2CO2(g)△H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
c(CO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
①下列可判断反应达到平衡状态的是___________(填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(CO)=V(CO2)
②此条件下达到平衡时,计算该反应的平衡常数K=________。
③为了提高尾气处理的效果,可采取的措施有_____________________(写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2和氮的氧化物气体(NOx),请写出氢氧化钠溶液吸收NO和NO2(两者体积比1:1)的离子方程式 ___________________。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如下图所示。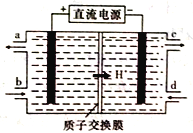
①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备纯净的液态无水四氯化锡的反应为Sn+2Cl2 ![]() SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
SnCl4, Sn也可以与HC1反应生成SnCl2(SnCl4易挥发形成气体,极易发生水解,水解生成SnO2·xH20)。已知:
物质 | 摩尔质量(g/mol) | 熔点(℃) | 沸点(℃) |
Sn | 119 | 231 | 2260 |
SnCl2 | 190 | 246 | 623 |
SnCl4 | 261 | -30 | 114 |
制备装置如图所示:
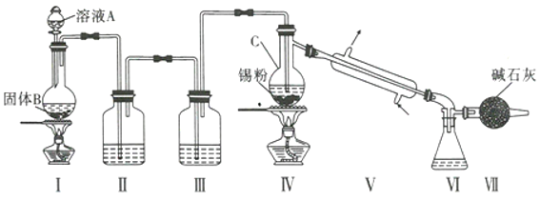
回答下列问题:
(1) Sn在元素周期表中的位罝为____________________________。
(2) Ⅱ、Ⅲ中的试剂分別为_______、__________;Ⅶ的作用是____________________、_____________。
(3)实验所得SnCl4因溶解了Cl2而略显黄色,提纯SnCl4的方法是____________(填序号)。
a.用NaOH溶液洗涤再蒸馏 b.升华 c.重结晶 d.蒸馏 e.过滤
(4)写出I中反应的化学方程式:_____________________________________。
(5)加热Sn粒之前要先让氯气充满整套装置,其目的是_________________。
(6)写出SnCl4水解的化学方程式:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用钒炉渣(主要含FeO·V2O5,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。

(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1 mol O2与1 mol N2的总能量比2 mol NO的总能量________(填“高”或“低”)。
②![]() N2(g)+
N2(g)+![]() O2(g)===NO(g)的ΔH=________。
O2(g)===NO(g)的ΔH=________。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值________(选填“增大”“减小”或“不变”)。
2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值________(选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH1。下图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH1________(选填“>”“=”或“<”)0。
②图中途径(Ⅱ)的条件是_______________,途径(Ⅰ)的反应热________(选填“>”“=”或“<”)途径(Ⅱ)的反应热。
③已知下列两个热化学方程式:
H2(g)+![]() O2(g)===H2O(g) ΔH2
O2(g)===H2O(g) ΔH2
2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(g) ΔH3
ΔH1、ΔH2、ΔH3三者的关系式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如下:
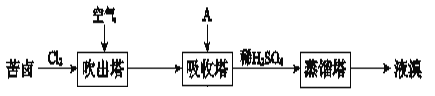
(1)Cl2和苦卤中的Br﹣反应生成Br2的离子方程式是_____。
(2)结合元素周期律解释Cl的非金属性强于Br的原因:_____。
(3)吸收塔中,A吸收了Br2后的溶液中含有Br﹣和BrO3﹣,则A是_____(填序号)。
a.NaCl溶液 b.Na2CO3溶液 c.SO2气体
(4)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验及现象能推出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 向苯酚钠溶液中加入NaHSO3溶液 | 溶液变浑浊 | 酸性:H2SO3>苯酚 |
B | 向KI淀粉溶液中滴入无色溶液X | 溶液变蓝色 | X一定为H2O2溶液 |
C | 将3体积SO2与1体积O2混合并通过灼热的催化剂充分反应,产物依次通过BaCl2溶液和品红溶液 | 前者产生白色沉淀,后者溶液褪色 | SO2与O2的反应为可逆反应 |
D | 向2支均盛有2mL1.0mol·L-1的KOH溶液的试管中,分别加入2滴浓度均为0.1mol·L-1的AlCl3和FeCl3溶液 | 一支试管出现红褐色沉淀,另一支无明显现象 | Ksp[Al(OH)3]> Ksp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com