
| ���� | X | Y | Z |
| ��ʼ���ʵ�����mol�� | 0.2 | 0.2 | 0 |
| ƽ�����ʵ�����mol�� | 0.1 | 0.05 | 0.1 |
| A����Ӧ�ɱ�ʾΪ2X+3Y?2Z����ƽ�ⳣ��Ϊ8000 |
| B������ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ |
| C���������������ѹ����1L����X�����������С��Ũ������ |
| D���������¶�ʱ��Z��Ũ������֪�¶�����ʱ����Ӧ���������淴Ӧ���ʼ�С��ƽ�⳯����Ӧ�����ƶ� |
| c2(z) |
| c2(x)?c2(y) |
(
| ||||
(
|


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
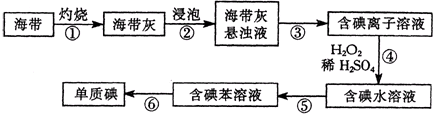
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������A��ʾ�ķ�Ӧ����Ϊ1.2 mol/��L?s�� |
| B��2 sʱ����A��ת����Ϊ30% |
| C��������B��ʾ�ķ�Ӧ����Ϊ0.6 mol/��L?s�� |
| D��2 sʱ����B��Ũ��Ϊ0.6 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Na+��MnO4-��K+��NO3-��SO32- |
| B��Na+��CO32-��Cl-��Al3+��NO3- |
| C��Na+��S2-��OH-��K+��Cl-��NO3- |
| D��Fe2+��H+��Na+��Ca2+��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���к�ʱ�����������Ƶ����ʵ��� |
| B��H+�����ʵ���Ũ�� |
| C������ƽ�ⳣ��K |
| D��H+�����ʵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
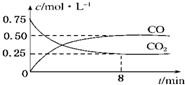 ij�¶��£���һ�ܱ������г���һ����CO2���������������ۣ�������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g�������CO2��COŨ����ʱ��ı仯��ͼ��ʾ��
ij�¶��£���һ�ܱ������г���һ����CO2���������������ۣ�������Ӧ��Fe��s��+CO2��g��?FeO��s��+CO��g�������CO2��COŨ����ʱ��ı仯��ͼ��ʾ��| c(CO) |
| c(CO2) |
| �¶�/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
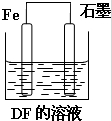 A��B��C��D��E��F���ֶ���������Ԫ�أ���ԭ��������������A��Dͬ���壻A��B��C�����γɶ��ֳ�����10����������ͬһ�����У������Ӱ뾶E����С��ԭ�Ӱ뾶F����С��B�ĵ��ʷ����������Թ��õ��Ӷԣ���ش��������⣺
A��B��C��D��E��F���ֶ���������Ԫ�أ���ԭ��������������A��Dͬ���壻A��B��C�����γɶ��ֳ�����10����������ͬһ�����У������Ӱ뾶E����С��ԭ�Ӱ뾶F����С��B�ĵ��ʷ����������Թ��õ��Ӷԣ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com