
A.q<p<2q B.p<2q
C.p=2q D.p³2q
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:四川省高考真题 题型:实验题
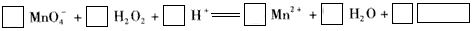
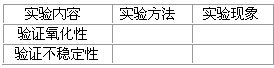
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)工业制硫酸生产流程如下图:
|

(1)造气阶段,为提高反应的效率,充分利用含硫矿石,请你提出两条可行的措施:
、
|
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1
 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,SO2的浓度是原平衡时的60%,则
A.平衡向逆反应方向移动了
B.SO2的转化率减小了
C.SO3的质量分数增加了
D.平衡移动过程中,v(逆)< v(正)
(3)在催化反应室,发生(2)中的反应,已知:某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答:
①将1.0mol SO2和0.05mol O2置于10L密闭容器中,反应达平衡后,若体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B) (填“>”、“<”或“=”)。
(4)增大体系的压强能使(2)中平衡向正反应方向移动,但在实际生产中采用了常压的条件,你认为可能的原因是: 。
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高考化学模试试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com