
| A. | 碳酸钠 | B. | 乙醇 | C. | 氯化钾 | D. | 一氧化碳 |
科目:高中化学 来源: 题型:选择题
| A. | 与软脂酸属于同系物的最简单有机物是甲酸 | |
| B. | 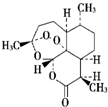 青蒿素是抗疟疾特效药,结构如图所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,能够发生水解反应,具有强氧化性 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 有X、Y两种有机物,不论何种比例混合,只要其物质的量之和不变,完全燃烧时耗氧气量和生成水的物质的量也不变,若X为CH4,则Y可以是CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | B. | CH2=CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | D. | 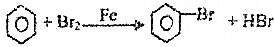 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
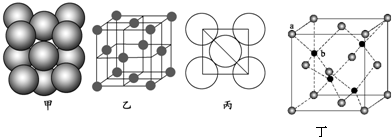
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
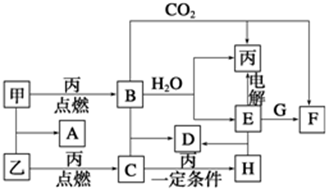
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 v(NH3)=5 v(O2) | B. | 5 v(O2)=6 v(H2O) | C. | 5 v(NO)=4 v(O2) | D. | 3 v(H2O)=2 v(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
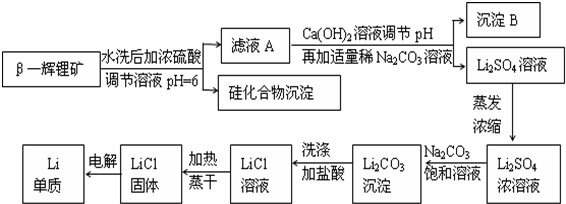
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
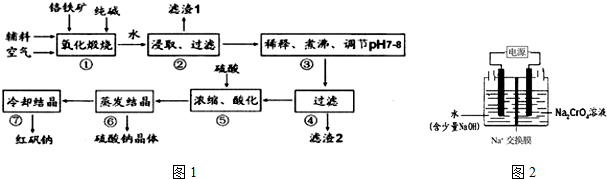
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
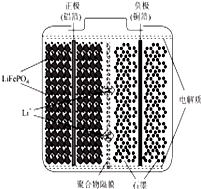 锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.
锂离子电池广泛应用与日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新呈”.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com