
 二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:分析 (1)已知反应①是体积减小的放热反应,根据外界条件对平衡的影响分析;
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,根据v(CO)=$\frac{△c}{△t}$计算v(CO);
计算该温度下的平衡常数,根据平衡常数计算平衡时氢气的浓度,根据甲醇的平衡浓度计算氢气浓度的变化量,进而计算a的值;
(3)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;
(4)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式;
(5)依据图示分析通入氧气的一端为正极,通入二甲醚的一端为负极,电解质溶液为酸性环境,二甲醚失电子生成二氧化碳,根据电子守恒写出电极反应.
解答 解:(1)已知反应①是体积减小的放热反应,若要增大反应①中H2的转化率,则需要使平衡正移,所以改变的条件为加入一定量CO或反应温度降低;
故答案为:BC;
(2)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,所以v(CO)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min);
该温度到达平衡时,c(CO)=0.5mol/L,c(H2)=2.4mol/L-2×0.5mol/L=1.4mol/L,c(CH3OH)=0.5mol/L,所以该温度下,平衡常数k=$\frac{0.5}{0.5×1.{4}^{2}}$=$\frac{25}{49}$,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c′(CO)=4mol/L-2mol/L=2mol/L,令平衡时氢气的浓度为ymol/L,所以$\frac{2}{2×{y}^{2}}$=$\frac{25}{49}$解得y=1.4,故a=2mol/L×2+1.4mol/L=5.4mol/L.
故答案为:0.1mol/(L•min);5.4.
(3)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
催化反应室中温度低于830°C,反应是放热反应,降低温度平衡正向进行,平衡常数增大,K>1.0,
故答案为:-246.1kJ/mol,>;
(4)甲醚的燃烧热为1455kJ/mol,则燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
(5)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+;
故答案为:CH3OCH3+3H2O-12e-═2CO2+12H+.
点评 本题考查热化学方程式书写,燃烧热概念,平衡移动,图象分析应用,原电池电极反应的书写方法,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化铜溶于盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
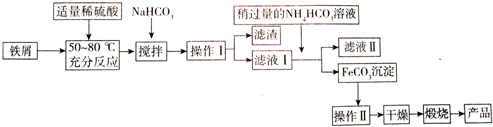
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 沉淀完全 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 参加反应的氯气的物质的量等于0.5a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{a}{6}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由0.1mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合而成 | |
| B. | 由10mLpH=3的CH3COOH溶液与1 mL pH=11的NaOH溶液混合而成 | |
| C. | 由0.1mol•L-1的CH3COONa溶液与0.1 mol•L-1的NaOH溶液等体积混合而成 | |
| D. | 由0.1mol•L-1的CH3COONa溶液与0.1 mol•L-1的CH3COOH溶液等体积混合而成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com