
| A. | 硅(半导体材料) | B. | 二氧化硅(制光导纤维) | ||
| C. | Na2Si03 (用作粘合剂,俗称水玻璃) | D. | Al(OH)3(用作胃药,俗称人造刚玉) |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| B. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 含有amolFeBr2的溶液中,通入0.4amolCl2:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用两块铜片作电极电解盐酸:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
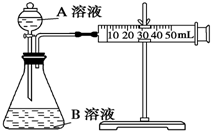 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A | B |
| 1 | 2ml0.1mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 2 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 3 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液和少量MnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
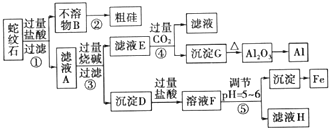
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q=197KJ | B. | Q<197×2 KJ | C. | Q<197KJ | D. | Q>197KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X与元素Y能形成离子化合物 | |
| B. | 原子序数为:X<Y<Z | |
| C. | 元素Z最高价氧化物对应水化物具有两性 | |
| D. | 元素Y形成的气态氢化物水溶液呈强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com