
| A. | K+、Na+、SO42-、CO32- | B. | NH4+、Mg2+、SO32-、Cl- | ||
| C. | Na+、K+、HCO3-、Cl- | D. | K+、Cu2+、CO32-、NO3- |
分析 与铝反应能放出氢气的溶液,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:与铝反应能放出氢气的溶液,为酸或碱溶液,
A.碱溶液中该组离子之间不反应,可大量共存,故A选;
B.碱溶液中不能大量存在NH4+、Mg2+,酸溶液中不能大量存在SO32-,故B不选;
C.酸、碱溶液中均不能大量存在HCO3-,故C不选;
D.酸溶液中不能大量存在CO32-,碱溶液中不能大量存在Cu2+,且Cu2+、CO32-结合生成沉淀,不能共存,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
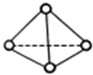 科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )
科学家己获得了极具理论研究意义的N4分子,其结构为正四面体型(如图所示),分子中每个氮原子最外电子层都满足8电子结构.己知断裂1mol N-N键吸收192kJ热量,断裂1mol键N≡N吸收946kJ热量,则下列叙述中正确的是( )| A. | 1molN4气体转化为N2时要吸收206 kJ能量 | |
| B. | N4是一种比N2更稳定的分子 | |
| C. | 1molN4气体转化为N2时要放出740 kJ能量 | |
| D. | N4与N2之间不是同素异形体关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔沸点由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 沸点由高到低:HI>HBr>HCl>HF | |
| D. | 硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质分子的粒子之间不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 阴、阳离子间通过离子键一定能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 乙醇的蒸发和氧化铝的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.4mol•L-1 | B. | X2为0.2 mol•L-1 | C. | Y2为0.4 mol•L-1 | D. | Z为0.3 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 . (加聚反应)
. (加聚反应) . (取代反应)
. (取代反应)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com