
| A. | 含2.8 mol电子的Mg34S晶体中34S所含中子数为1.8NA | |
| B. | 17gH2O2中所含极性键总数为0.5NA | |
| C. | 31gFeI2与足量氯气反应时转移的电子数为0.2NA | |
| D. | 以Mg、Al为电极,NaOH 溶液为电解质溶液的原电池中,若正极生成的H2体积为22.4L,导线上流过2NA个电子 |
分析 A.1个Mg34S含有28个电子,一个34S含有18个中子;
B.1个过氧化氢含有2个O-H键;
C.1mol碘化亚铁与足量氯气反应,碘离子、二价铁离子都参加反应,失去3mol电子;
D.气体状况未知.
解答 解:A.含2.8 mol电子的Mg34S晶体物质的物质的量为0.1moL,则含有0.1mol34S,晶体中34S所含中子数为1.8NA,故A正确;
B.17gH2O2中所含极性键总数为$\frac{17g}{34g/mol}$×2×NA=NA,故B错误;
C.31gFeI2物质的量为$\frac{31g}{310g/mol}$=0.1mol,与足量氯气反应时转移的电子数为0.3NA,故C错误;
D.气体状况未知,无法确定气体摩尔体积,无法计算氢气物质的量和转移电子数,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意氧化还原反应转移电子数目的计算方法及气体摩尔体积使用条件,题目难度不大.


科目:高中化学 来源: 题型:解答题
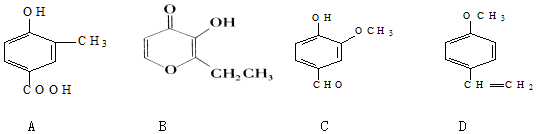
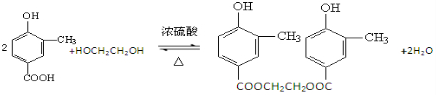 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气溶于水能导电,故氨气属于电解质 | |
| B. | 碳酸钡难溶于水,故碳酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 室温下,氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C | B. | N | C. | S | D. | C1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 非金属性:甲<丙 | B. | 原子半径:乙<丁 | ||
| C. | 最外层电子数:乙<丙 | D. | 戊一定是硫元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com