
”¾ĢāÄæ”æijŠ£Ń§ÉśÓĆČēĻĀĶ¼ĖłŹ¾×°ÖĆ½ųŠŠŹµŃ飬ŅŌĢ½¾æ±½Óėäå·¢Éś·“Ó¦µÄŌĄķ²¢·ÖĄėĢį“æ·“Ó¦µÄ²śĪļ”£
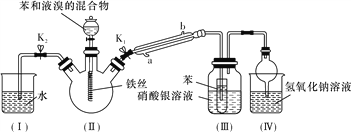
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŹµŃéæŖŹ¼Ź±£¬¹Ų±ÕK2”¢æŖĘōK1ŗĶ·ÖŅŗĀ©¶·»īČū£¬µĪ¼Ó±½ŗĶŅŗäåµÄ»ģŗĻŅŗ£¬·“Ó¦æŖŹ¼”£×°ÖĆ¢ņÖŠÉś³ÉÓŠ»śĪļµÄ·“Ó¦ĪŖ__________________________________________(Ģī»Æѧ·½³ĢŹ½)£¬×°ÖĆ¢óÖŠŠ”ŹŌ¹ÜÄŚ±½µÄ×÷ÓĆŹĒ__________________________________”£
(2)ÄÜĖµĆ÷±½ÓėŅŗäå·¢ÉśĮĖČ”“ś·“Ó¦µÄĻÖĻóŹĒ_____________________”£
(3)·“Ó¦½įŹųŗó£¬ŅŖČĆ×°ÖĆ¢ńÖŠµÄĖ®µ¹ĪüČė×°ÖĆ¢ņÖŠ£¬ÕāŃł²Ł×÷µÄÄæµÄŹĒ___________”£¼ņŹöÕāŅ»²Ł×÷µÄ·½·Ø__________”£
(4)½«Čż¾±ÉÕĘæÄŚ·“Ó¦ŗóµÄŅŗĢåŅĄ“Ī½ųŠŠĻĀĮŠŹµŃé²Ł×÷¾ĶæɵƵ½½Ļ“æ¾»µÄäå±½”£
¢ŁÓĆÕōĮóĖ®Ļ“µÓ”¢Õńµ“”¢·ÖŅŗ£»¢ŚÓĆ5%µÄNaOHČÜŅŗĻ“µÓ”¢Õńµ“”¢·ÖŅŗ£»¢ŪÓĆÕōĮóĖ®Ļ“µÓ”¢Õńµ“”¢·ÖŅŗ£»¢Ü¼ÓČėĪŽĖ®CaCl2·ŪÄ©øÉŌļ£»¢Ż_______________(Ģī²Ł×÷Ćū³Ę)”£
”¾“š°ø”æ 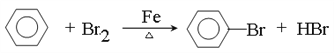 ĪüŹÕäåÕōĘų ×°ÖĆ¢óÖŠĻõĖįŅųČÜŅŗÄŚ³öĻÖµ»ĘÉ«³Įµķ(»ņ²ā·“Ó¦ŗó×°ÖĆ¢óÖŠĻõĖįŅųČÜŅŗµÄpH£¬ĘäpH±äŠ”) ±ÜĆā×°ÖĆ¢ņÖŠµÄHBrŅŻ³öĪŪČ¾æÕĘų ĻČ¹Ų±ÕK1ŗĶ·ÖŅŗĀ©¶·»īČū£¬Č»ŗóæŖĘōK2 ÕōĮó
ĪüŹÕäåÕōĘų ×°ÖĆ¢óÖŠĻõĖįŅųČÜŅŗÄŚ³öĻÖµ»ĘÉ«³Įµķ(»ņ²ā·“Ó¦ŗó×°ÖĆ¢óÖŠĻõĖįŅųČÜŅŗµÄpH£¬ĘäpH±äŠ”) ±ÜĆā×°ÖĆ¢ņÖŠµÄHBrŅŻ³öĪŪČ¾æÕĘų ĻČ¹Ų±ÕK1ŗĶ·ÖŅŗĀ©¶·»īČū£¬Č»ŗóæŖĘōK2 ÕōĮó
”¾½āĪö”æ·ÖĪö£ŗ£Ø1£©±½ÓėŅŗäå·“Ó¦Éś³Éäå±½ŗĶäå»ÆĒā£»øł¾ŻäåŅ×»Ó·¢¼°Ņ×ČÜÓŚÓŠ»śČܼĮ½ųŠŠ·ÖĪö£»
£Ø2£©øł¾ŻÉś³ÉĒ³»ĘÉ«³Įµķäå»ÆŅųÅŠ¶Ļ£»
£Ø3£©×°ÖĆIIÖŠŗ¬ÓŠäå»ÆĒāĘųĢåÄÜĪŪČ¾æÕĘų£»
£Ø4£©ĶعżÕōĮó·½·Ø»ńµĆ“æ¾»µÄäå±½”£
Ļź½ā£ŗ£Ø1£©ŌŚ“߻ƼĮ×÷ÓĆĻĀ£¬±½ÓėŅŗäå·¢ÉśČ”“ś·“Ӧɜ³Éäå±½ŗĶäå»ÆĒā£¬Ōņ×°ÖĆ¢ņÖŠÉś³ÉÓŠ»śĪļµÄ·“Ó¦·½³ĢŹ½ĪŖ £»ÓÉÓŚŅŗäåŅ×»Ó·¢£¬»įøÉČÅäå»ÆĒāµÄ¼ģŃ飬ĖłŅŌ¢óÖŠŠ”ŹŌ¹ÜÄŚ±½µÄ×÷ÓĆŹĒ³żČ„äå»ÆĒāÖŠµÄäåÕōĘų£¬±ÜĆāøÉČÅäåĄė×Ó¼ģŃ飻
£»ÓÉÓŚŅŗäåŅ×»Ó·¢£¬»įøÉČÅäå»ÆĒāµÄ¼ģŃ飬ĖłŅŌ¢óÖŠŠ”ŹŌ¹ÜÄŚ±½µÄ×÷ÓĆŹĒ³żČ„äå»ÆĒāÖŠµÄäåÕōĘų£¬±ÜĆāøÉČÅäåĄė×Ó¼ģŃ飻
£Ø2£©Ņņ“ÓĄäÄż¹Ü³öĄ“µÄĘųĢåĪŖäå»ÆĒā£¬äå»ÆĒā²»ČÜÓŚ±½£¬äå»ÆĒāÄÜÓėĻõĖįŅų·“Ӧɜ³Éäå»ÆŅų³Įµķ£¬ĖłŅŌÄÜĖµĆ÷±½ÓėŅŗäå·¢ÉśĮĖČ”“ś·“Ó¦µÄĻÖĻóŹĒ×°ÖĆ¢óÖŠĻõĖįŅųČÜŅŗÄŚ³öĻÖµ»ĘÉ«³Įµķ£»
£Ø3£©Ņņ×°ÖĆ¢ņÖŠŗ¬ÓŠäå»ÆĒāĘųĢåÄÜĪŪČ¾æÕĘų£¬Ź¹IµÄĖ®µ¹ĪüČė¢ņÖŠæÉŅŌ³żČ„äå»ÆĒāĘųĢ壬ŅŌĆāŅŻ³öĪŪČ¾æÕĘų£»²Ł×÷·½·ØĪŖĻČ¹Ų±ÕK1ŗĶ·ÖŅŗĀ©¶·»īČū£¬Č»ŗóæŖĘōK2£»
£Ø4£©¼ÓČėĪŽĖ®CaCl2·ŪÄ©øÉŌļ£¬ÓÉÓŚäå±½ŗĶ±½µÄ·ŠµćĻą²ī½Ļ“ó£¬Ņņ“ĖĶعżÕōĮó²Ł×÷¼“æÉ»ńµĆ“æ¾»µÄäå±½”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņŗ¬Fe2£«”¢I£”¢Br£µÄČÜŅŗÖŠĶØČė¹żĮæµÄĀČĘų£¬ČÜŅŗÖŠĖÄÖÖĮ£×ÓµÄĪļÖŹµÄĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ŅŃÖŖ£ŗb£a£½5£¬Ļ߶Ī¢ō±ķŹ¾Ņ»ÖÖŗ¬ŃõĖį£¬ĒŅ¢ńŗĶ¢ō±ķŹ¾µÄĪļÖŹÖŠŗ¬ÓŠĻąĶ¬µÄŌŖĖŲ”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. Ļ߶Ī¢ņ±ķŹ¾Fe2+µÄ±ä»ÆĒéæö
B. Ļ߶Ī¢ō·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗI2+5Cl2+12OH-=2IO3-+10Cl-+6H2O
C. øł¾ŻĶ¼ĻóæɼĘĖća=6
D. ŌČÜŅŗÖŠc(Fe2£«)”Ćc(I£)”Ćc(Br£)£½2”Ć1”Ć3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÄæµÄÄÜ“ļµ½µÄŹĒ£Ø £©
A.½«58.5 g NaClČÜÓŚ1 LĖ®ÖŠ£¬æɵĆ1 mol/LµÄNaClČÜŅŗ
B.æÉŹ¹ÓĆ250 mLČŻĮæĘæ·ÖĮ½“ĪĶź³É490 mLijÅØ¶ČµÄBaCl2ČÜŅŗµÄÅäÖĘ
C.½«25.0 gµØ·ÆČÜÓŚĖ®ŗóÅä³É100 mLČÜŅŗĖłµĆČÜŅŗÅضČĪŖ1 mol/L
D.½«78 g Na2O2ČÜÓŚĖ®Åä³É1 LČÜŅŗ£¬æɵƵ½ÅضČĪŖ1 mol/LµÄČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫Cu·ÅČėŹ¢ÓŠĻ”HNO3µÄČŻĘ÷ÖŠ·¢ÉśČēĻĀ·“Ó¦£ŗ3Cu+8HNO3(Ļ”)=3Cu(NO3)2 + 2x”ü+£“H2O£¬ŌņxĪŖĪŽÉ«µÄ____(Ģī»ÆѧŹ½)ĘųĢ壬ÓöæÕĘųŗóŃøĖŁ±äĪŖ____É«µÄNO2£¬øĆ·“Ó¦ÖŠŃõ»Æ¼ĮŹĒ____£¬»¹Ō¼ĮŹĒ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ¼ŗĶµŖµÄ»ÆŗĻĪļŌŚÉś²śÉś»īÖŠ¹ć·ŗ“ęŌŚ”£»Ų“šĻĀĮŠĪŹĢā:
(1)ČżĀČ»ÆµŖ(NCl3)ŹĒŅ»ÖÖ»ĘÉ«”¢ÓĶד”¢¾ßÓŠ“Ģ¼¤ŠŌĘųĪ¶µÄ»Ó·¢ŠŌÓŠ¶¾ŅŗĢ壬ĘäŌ×Ó¾łĀś×ć8e-½į¹¹”£Š“³öĘäµē×ÓŹ½_____________________”£ĀČ¼ī¹¤ŅµÉś²śŹ±£¬ÓÉÓŚŹ³ŃĪĖ®ÖŠĶس£ŗ¬ÓŠÉŁĮæNH4Cl£¬¶ųŌŚŅõ¼«ĒųÓėÉś³ÉµÄĀČĘų·“Ó¦²śÉśÉŁĮæČżĀČ»ÆµŖ£¬øĆ·“Ó¦µÄ»ÆѧĮ¦³ĢŹ½ĪŖ______________”£
(2)Ņ»¶ØĢõ¼žĻĀ£¬²»Ķ¬ĪļÖŹµÄĮæµÄCO2Óė²»Ķ¬Ģå»żµÄ1.0mol/LNaOHČÜŅŗ³ä·Ö·“Ó¦·Å³öµÄČČĮæČēĻĀ±ķĖłŹ¾:
·“Ó¦ŠņŗÅ | CO2µÄĪļÖŹµÄĮæ/mol | NaOHČÜŅŗµÄĢå»ż/L | ·Å³öµÄČČĮæ/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
øĆĢõ¼žĻĀCO2ÓėNaOHČÜŅŗ·“Ӧɜ³ÉNaHCO3µÄČČ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ:____________”£
(3)ĄūÓĆCOæÉŅŌ½«NO×Ŗ»ÆĪŖĪŽŗ¦µÄN2£¬Ęä·“Ó¦ĪŖ£ŗ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)£¬ĻņČŻ»ż¾łĪŖILµÄ¼×”¢ŅŅ”¢±ūČżøöŗćĪĀ(·“Ó¦ĪĀ¶Č·Ö±šĪŖ300”ę”¢T”ę”¢300”ę)ČŻĘ÷ÖŠ·Ö±š¼ÓČėĻąĶ¬ĮæNOŗĶCO£¬²āµĆø÷ČŻĘ÷ÖŠn(CO)Ėę·“Ó¦Ź±¼ätµÄ±ä»ÆĒéæöČēĻĀ±ķĖłŹ¾:
N2(g)+2CO2(g)£¬ĻņČŻ»ż¾łĪŖILµÄ¼×”¢ŅŅ”¢±ūČżøöŗćĪĀ(·“Ó¦ĪĀ¶Č·Ö±šĪŖ300”ę”¢T”ę”¢300”ę)ČŻĘ÷ÖŠ·Ö±š¼ÓČėĻąĶ¬ĮæNOŗĶCO£¬²āµĆø÷ČŻĘ÷ÖŠn(CO)Ėę·“Ó¦Ź±¼ätµÄ±ä»ÆĒéæöČēĻĀ±ķĖłŹ¾:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(¼×ČŻĘ÷)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(ŅŅČŻĘ÷)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(±ūČŻĘ÷)/mol | 1.00 | 0.65 | 0.53 | 0.45 |
¢Ł¼×ČŻĘ÷ÖŠ£¬0”«40minÄŚÓĆNOµÄÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(NO)=_______”£
¢ŚøĆ·“Ó¦µÄ”÷H______0(Ģī”°>”±»ņ”°<”±)”£
¢Ū±ūČŻĘ÷“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹĪŖ____________________________”£
(4)³£ĪĀĻĀ£¬ŌŚ(NH4)2C2O4ČÜŅŗÖŠ£¬·“Ó¦NH4++C2O42-+H2O![]() NH3”¤2H2O+HC2O4-µÄĘ½ŗā³£ŹżK=___”£(ŅŃÖŖ³£ĪĀĻĀ£¬NH3”¤H2OµÄµēĄėĘ½ŗā³£ŹżKb”Ö2”Į10-5£¬H2C2O4µÄµēĄėĘ½ŗā³£ŹżKa1”Ö5”Į10-2£¬Ka2”Ö5”Į10-5)
NH3”¤2H2O+HC2O4-µÄĘ½ŗā³£ŹżK=___”£(ŅŃÖŖ³£ĪĀĻĀ£¬NH3”¤H2OµÄµēĄėĘ½ŗā³£ŹżKb”Ö2”Į10-5£¬H2C2O4µÄµēĄėĘ½ŗā³£ŹżKa1”Ö5”Į10-2£¬Ka2”Ö5”Į10-5)
(5)ČēĶ¼ŹĒŌŚĖįŠŌµē½āÖŹČÜŅŗÖŠ£¬ŅŌĒéŠŌ²ÄĮĻ×÷µē¼«£¬½«CO2×Ŗ»ÆĪŖ±ūĻ©µÄŌĄķÄ£ŠĶ”£
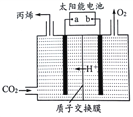
¢ŁĢ«ŃōÄܵē³ŲµÄøŗ¼«ŹĒ_________”£(Ģī”°a”±»ņ”°b”±)
¢ŚÉś³É±ūĻ©µÄµē¼«·“Ó¦Ź½ŹĒ____________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮśµØĖįõ„¶ŌĢåĶāÅąŃųµÄŗŚĖŲĻø°ū²śÉśŗŚĖŲµÄÄÜĮ¦ÓŠĆ÷ĻŌµÄŅÖÖĘŠ§Ó¦£¬ĒŅƻӊĻø°ū¶¾ŠŌŗĶÓÕ±äĮ¦”£ŹĒ”ŖÖÖøߊ§ĪŽ¶¾µÄŅ©Īļʤ·ōĆĄ°×¼Į”£ŗĻ³ÉĮśµØĖįĶ黳õ„ĄąĀ·ĻßČēĻĀ£ŗ
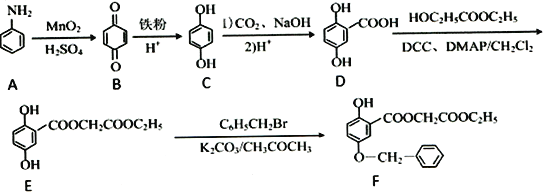
£Ø1£©FÖŠŗ¬Ńõ¹ŁÄÜĶŵÄĆū³ĘĪŖōĒ»ł”¢_____________”¢_____________”£
£Ø2£©E”śFµÄ·“Ó¦ĄąŠĶŹĒ_______________”£
£Ø3£©Š“³öD”śE·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ_________________________________”£
£Ø4£©Š“³öĀś×ćĻĀĮŠĢõ¼žµÄĮśµØĖįŅŅõ„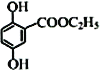 µÄČĪŅāŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½£ŗ__________”£
µÄČĪŅāŅ»ÖÖĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½£ŗ__________”£
¢ń.ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬ÓėFeCl3²»·¢ÉśĻŌÉ«·“Ó¦µ«ĘäĖ®½ā²śĪļÖ®Ņ»ÄÜÓėFeCl3·¢ÉśĻŌÉ«·“Ó¦
¢ņ.ŗĖ“Ź²ÕńĒāĘ×ÓŠĖÄ×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ6 : 2 : 1 : 1
£Ø5£©ŅŃÖŖ£ŗ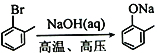 ”£Ė®ŃīĖįŅŅõ„£Ø
”£Ė®ŃīĖįŅŅõ„£Ø £©¹ć·ŗÓ¦ÓĆÓŚČÕÓĆĻćŌķµČ£¬øł¾ŻŅŃÓŠÖŖŹ¶²¢½įŗĻĻą¹ŲŠÅĻ¢£¬Š“³öŅŌ±½”¢ŅŅ“¼ĪŖŌĮĻÖʱøĖ®ŃīĖįŅŅõ„µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼£ØĪŽ»śŹŌ¼ĮČĪÓĆ£¬ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾Ąż¼ū±¾ĢāĢāøÉ£©___________________”£
£©¹ć·ŗÓ¦ÓĆÓŚČÕÓĆĻćŌķµČ£¬øł¾ŻŅŃÓŠÖŖŹ¶²¢½įŗĻĻą¹ŲŠÅĻ¢£¬Š“³öŅŌ±½”¢ŅŅ“¼ĪŖŌĮĻÖʱøĖ®ŃīĖįŅŅõ„µÄŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼£ØĪŽ»śŹŌ¼ĮČĪÓĆ£¬ŗĻ³ÉĀ·ĻßĮ÷³ĢĶ¼Ź¾Ąż¼ū±¾ĢāĢāøÉ£©___________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓÉ2©ĀȱūĶéÖʵĆÉŁĮæµÄHOCH2CH£ØOH£©CH3 ŠčŅŖ¾¹żĻĀĮŠ¼ø²½·“Ó¦£Ø £©
A.ĻūČ„”ś¼Ó³É”śĖ®½ā
B.¼Ó³É”śĻūČ„”śČ”“ś
C.Č”“ś”śĻūČ„”ś¼Ó³É
D.ĻūČ„”ś¼Ó³É”śĻūČ„
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĦ°Żµ„³µĄūÓĆ³µĄŗ“¦µÄĢ«ŃōÄܵē³Ų°åĻņÖĒÄÜĖųÖŠµÄļ®Ąė×Óµē³Ų³äµē,µē³Ų·“Ó¦ŌĄķĪŖ:LiCoO2+6C![]() Li1-xCoO2+LixC6”£Ź¾ŅāĶ¼ČēÓŅ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
Li1-xCoO2+LixC6”£Ź¾ŅāĶ¼ČēÓŅ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ³äµēŹ±£¬Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ Li1-xCoO2+xLi++xe-=LiCoO2
B. øĆ×°ÖĆ¹¤×÷Ź±Éę¼°µ½µÄÄÜĮæŠĪŹ½ÓŠ3ÖÖ
C. ³äµēŹ±ļ®Ąė×ÓÓÉÓŅĻņ×óŅʶÆ
D. ·ÅµēŹ±,Õż¼«ÖŹĮæŌö¼Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A.°“ĻµĶ³ĆüĆū·ØCH3CH(CH3)2µÄĆū³ĘĪŖŅģ¶”Ķé
B.ĘĻĢŃĢĒŗĶÕįĢĒ¶¼ŹĒµ„ĢĒ
C.ŅŅ“¼ŗĶŅŅĖį¶¼ÄÜÓėĖ®ŅŌČĪŅā±Č»„ČÜ
D.·ÖĮóĘūÓĶŗĶĮŃ»ÆĘūÓĶÓėäåĖ®¶¼²»·“Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com