
 食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症.下列关于这种有毒物质的判断正确的是( )
食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症.下列关于这种有毒物质的判断正确的是( )| A. | 该物质分子中含有两种官能团 | |
| B. | 该物质的分子式为C9H15O2 | |
| C. | 1mol该物质最多可以和2molH2发生加成反应 | |
| D. | 该物质不能发生银镜反应 |
科目:高中化学 来源: 题型:解答题
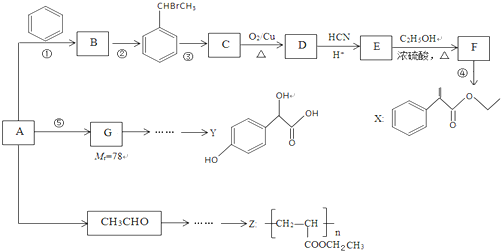
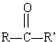 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$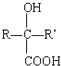 R或R′可以是烃基或氢原子
R或R′可以是烃基或氢原子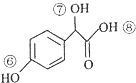 的说法正确的是AD.
的说法正确的是AD. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
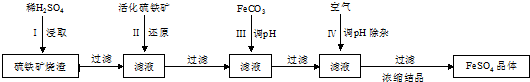
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
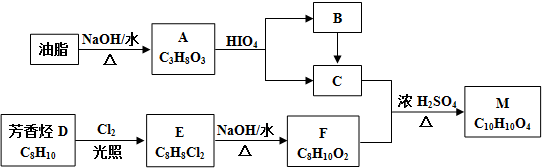
 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$  +
+
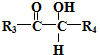 $\stackrel{HIO_{4}}{→}$R3COOH+
$\stackrel{HIO_{4}}{→}$R3COOH+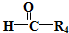
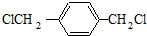 .
.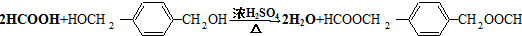 .
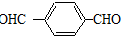
.
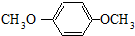

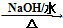 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 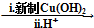 HCOOH
HCOOH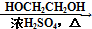 HCOOCH2CH2OOCH.
HCOOCH2CH2OOCH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 | |
| B. | 己烷和苯可以用酸性高锰酸钾溶液鉴别 | |
| C. | 甲烷和氯气反应生成一氯甲烷,苯和氢气反应生成环己烷,二者反应类型相同 | |
| D. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
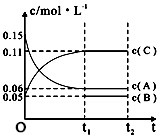
| A. | 若a=3,则b=1,c=2 | |
| B. | t1min时,该反应达到该条件下的反应限度 | |
| C. | 在O~t1min内,用C表示的化学反应速率为0.06mol•L-1 | |
| D. | B的起始浓度等于0.08mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
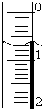 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com