
【题目】(1) CO2与NH3反应可合成化肥尿素。已知:
①2NH3(g)+CO2(g) = NH2CO2NH4(s) ΔH= -159.5kJmol-1
②NH2CO2NH4(s) = CO(NH2)2(s)+H2O(g) ΔH= +116.5kJmol-1
③H2O(l) = H2O(g) ΔH= +44.0kJmol-1
写出CO2与NH3合成尿素[CO(NH2)2]和液态水的热化学反应方程式_____
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当1mol Cl2参与反应时释放145kJ的热量,写出这个反应逆反应的热化学方程式:______ 。
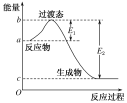
(3)下图是1mol NO2(g)与1mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。
(4)已知H—H键、N≡N键、N-H键的键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/(kJ·mol-1) | 436 | 946 | 391 |
则反应N2(g)+3H2(g)=2NH3(g)的 ΔH=________。
【答案】2NH3(g)+CO2(g) =CO(NH2)2(s)+H2O(l) ΔH= -87.0kJmol-1 4HCl(g)+CO2(g) = 2Cl(g)+2H2O(g)+C(s) ΔH= +290kJmol-1 减小 不变 -92kJmol-1
【解析】
(1)依据热化学方程式和盖斯定律计算①+②-③得到CO2与NH3合成尿素和液态水的热化学反应方程式为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H= -87.0kJmol-1;
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,2mol氯气完全反应放热290kJ,热化学方程式为2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g) △H= -290kJmol-1;
(3)催化剂能降低反应的活化能,在反应体系中加入催化剂E1减小;焓变与化学方程式的系数有关,在反应体系中加入催化剂ΔH不变;
(4)N2(g)+3H2(g)=2NH3(g) ΔH= -92kJmol-1,根据反应热的定义可知ΔH=反应物的键能之和-生成物的键能之和,即ΔH=(946+3×436-6×391)kJ/mol= -92kJmol-1。


科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 该溶液的pH=4 B. 升高温度,溶液的pH和电离平衡常数均减小
C. 此酸的电离平衡常数约为1×10-7 D. 加入少量纯HA,电离程度减小电离平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )

A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:

已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
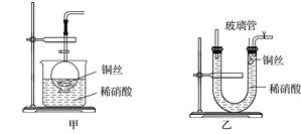
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
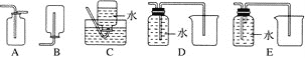
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)![]() 2HI(g)已经达到平衡的标志是( )
2HI(g)已经达到平衡的标志是( )
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H2的生成速率之比是2∶1
C.单位时间内一个H-H键断裂的同时有两个H-I键断裂
D.单位时间里断裂2nmolHI的同时生成nmolI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法不正确的是( )
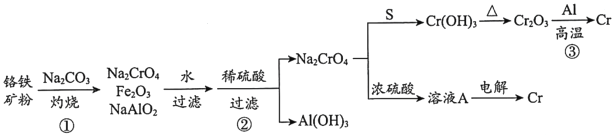
A.①中需持续吹入空气作氧化剂B.②中需加入过量稀硫酸
C.③中发生了置换反应D.溶液A为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
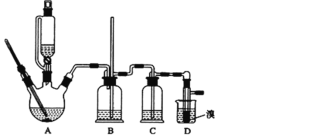
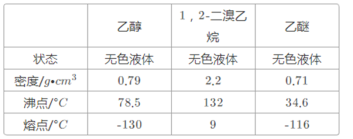
【题目】实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OH![]() CH2=CH2,CH2=CH2+Br2→CH2BrCH2Br
CH2=CH2,CH2=CH2+Br2→CH2BrCH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是__。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入__,(填序号)其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是__。
(4)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__层(填“上”、“下”)
(5)若产物中有少量未反应的Br2,最好用___洗涤除去(填序号)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用___的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是__,但又不能过度冷却(如用冰水),其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
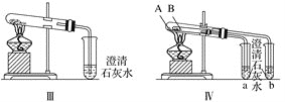
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,采用了不同的实验方法(装置如图所示)。
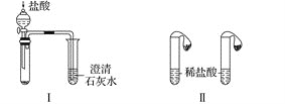
(1)根据上图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)____。
(2)图Ⅲ所示实验能够鉴别这两种物质,其反应的化学方程式为_______。
(3)图Ⅳ不仅能鉴别碳酸钠和碳酸氢钠,同时又能验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的物质为__________,实验过程中的现象为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com