
| A、2mol SO2和1mol O2在一定条件下反应,反应后分子总数大于2NA |
| B、25℃,在pH=2的1.0L H2SO4溶液中含有H+数目为0.01NA |
| C、在二氧化硅的晶体中,1mol SiO2含有Si-O键数目为NA |
| D、25mL 18mol?L-1浓硫酸与足量Zn反应,转移电子数为0.225NA |
| 1 |
| 2 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、向盐酸中滴加氨水:H++OH-═H2O |
| B、利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ |
| C、将少量Cl2通入KBr、KI的混合溶液中:Cl2+2Br-═Br2+2Cl- |
| D、向次氯酸钙溶液中通入少量的CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
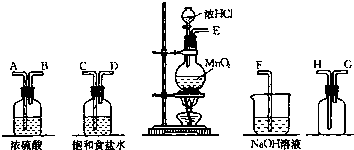
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若金属剩余,向溶液中再滴入硫酸后,金属又开始溶解 |
| B、若金属全部溶解,则溶液中一含有Fe3+ |
| C、若金属全部溶解,且产生336ml气体(标准状况),则b=0.3 |
| D、当溶液中金属离子只有Fe3+、Cu2+时,则a和b的关系没法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
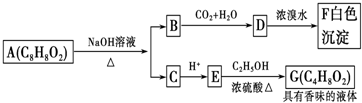
| A、根据图示可推知D为苯酚 |
| B、G的同分异构体中属于酯且能发生银镜反应的只有一种 |
| C、上述各物质中能发生水解反应的有A、B、D、G |
| D、A的结构中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
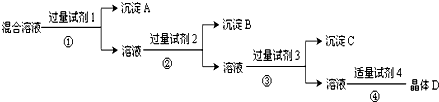
| A、氯化钡溶液 硝酸银溶液 硝酸溶液 |
| B、氯化钡溶液 硝酸溶液 硝酸银溶液 |
| C、NaOH 溶液 硝酸银溶液 硝酸溶液 |
| D、硝酸银溶液 硝酸钡溶液 硝酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
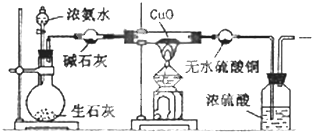
查看答案和解析>>
科目:高中化学 来源: 题型:
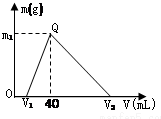 常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL c(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )| A、原合金质量为 0.92 g |
| B、图中V2为 100 |
| C、整个加入盐酸过程中 Na+的浓度保持不变 |
| D、Q点m1为0.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:
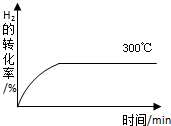 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) 下表为不同温度下的平衡常数(K)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)═CH3OH(g) 下表为不同温度下的平衡常数(K)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com