
【题目】下列各组中的性质比较,不正确的是
A. 酸性:HClO4>H2SO4>H3PO4 B. 稳定性:NH3<PH3<SiH4
C. 碱性:KOH>NaOH>Mg(OH)2 D. 还原性:F﹣<Cl﹣<Br﹣
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】短周期三种元素X、Y、Z,原子序数依次递增,它们的最高价氧化物的水化物皆为强酸,下列说法不正确的是( )
A. Y 在自然界中存在游离态 B. 最高正价:X > Y > Z
C. Y 气态氢化物溶于水呈酸性 D. 非金属性:Y < Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-![]() CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________。
(2)步骤2 中所发生反应的离子方程式为_________________。
(3)步骤3 中加入过量KI的作用是_________________。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(Lmin)、②vC=0.5mol/(Lmin)、③vB=0.5mol/(Lmin),三种情况下该反应速率由大到小的关系是 . (用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: 
①该反应的化学方程式为 .
②反应开始至2min,以气体Z表示的平均反应速率为 .
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填“大”,“小”或“相等”下同),混合气体密度比起始时 .
④上述反应,在第2min时,X的转化率为 .
⑤将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),则原混合气体中a:b= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途都正确且具有对应关系的是( )
A.ClO2具有强氧化性,可用于水消毒剂
B.石英熔点高,可用于制造石英研钵
C.氢氧化铝受热易分解,可用作胃酸中和剂
D.生石灰能与水反应,可用于干燥氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
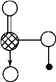
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A、碳酸钙溶解于稀硝酸中:CO32—+2H+==CO2↑+H2O
B、氯化钠溶液中滴加硝酸银溶液:Cl—+AgNO3==AgCl↓+NO3—
C、盐酸中滴入氨水:H++OH—==H2O
D、碳酸氢钠溶液与NaOH溶液混合:HCO3—+OH—==CO32—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中不正确的是( )
A. 该分散系能发生丁达尔现象 B. 该分散质颗粒能透过滤纸
C. 该分散质颗粒能透过半透膜 D. 该分散质颗粒能发生布朗运动
查看答案和解析>>
科目:高中化学 来源: 题型:
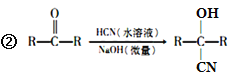
【题目】氰基烯酸酯在碱性条件下能快速聚合为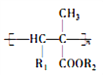 ,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(H)的合成路线如下:
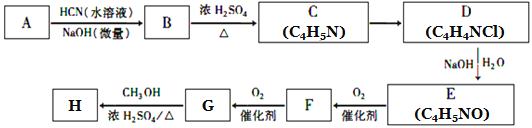
已知:①A的相对分子量为58,氧元素质量分数为0. 276,核磁共振氢谱显示为单峰;
回答下列问题:
(1)A的化学名称为____________。
(2)C的结构简式为________________,F中的含氧官能团名称是________________。
(3)由E生成F的反应类型为_____________,由G生成H的反应类型为_____________。
(4)由G生成H的化学方程式为________________________________。
(5)写出A的能够发生银镜反应的同分异构体的结构简式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com