

| Fe3 | Fe2+ | Cu2+ | Al3+ | |
| 开始沉淀时的 pH | 2.2 | 7.5 | 5.2 | 3.7 |
| 完全沉淀时的 pH | 3.2 | 9.0 | 6.7 | 4.7 |
分析 实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4•xH2O):向废铜合金中加入稀硫酸和硝酸的混酸,铜铁铝均转化成对应硫酸盐(因有剩余金属,铁应变成了亚铁离子,硝酸根离子完全反应),在滤液A中加入双氧水把将Fe2+氧化为Fe3+,在滤液B中加入氧化铜或氢氧化铜,调节溶液的PH,使Fe3+和Al3+完全沉淀下来,过滤后得滤液D为硫酸铜溶液,加硫酸酸化然后经蒸发浓缩、冷却结晶等步骤得到晶体,据此分析解答.
解答 解:(1)加入混酸后,合金中铜被酸性条件下的硝酸根离子氧化为铜离子溶解,离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
(2)a.称量操作至少要进行4次,包括加热前称量坩埚的质量、坩埚和晶体的总质量,加热后称量、再加热再称量直至质量不再减少为止,故a正确;
b.坩埚可直接加热,不放在石棉网上,故b错误;
故答案为:b.
点评 本题考查了物质的制备,主要考察了金属与氧化性酸的反应和物质的定量分析,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:H2SiO4<H2CO3<H3PO4 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 还原性强弱:F->Cl->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体一定是均一、透明、介稳的 | B. | 用丁达尔效应区别胶体和溶液 | ||
| C. | 可以用滤纸来分离胶体和溶液 | D. | 胶体只能在液体中形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,含有手性碳原子的有机物具有光学活性,下边有机物含有一个手性碳原子(*C表示手性碳原子),具有光学活性.若要消除其光学活性,可选用下列哪些化学反应( )| A. | 只有①②③ | B. | 只有④⑤⑥ | C. | 只有①②④⑤⑥ | D. | 以上都可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,产生H2速率减小,H2体积不变 | |
| B. | 加入NH4HSO4固体,产生H2速率不变,H2体积不变 | |
| C. | 加入CH3COONa固体,产生H2速率减小,H2体积减小 | |
| D. | 滴加少量CuSO4溶液,产生H2速率变大,H2体积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.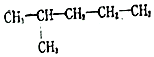 2-甲基戊烷
2-甲基戊烷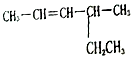 4-甲基-2-己烯.
4-甲基-2-己烯.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
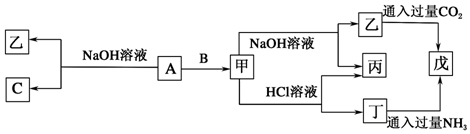
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com