

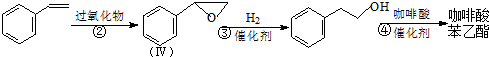
 的芳香化合物共有5种
的芳香化合物共有5种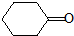 )与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为 的芳香化合物的结构,并判断;
的芳香化合物的结构,并判断; ;咖啡酸苯乙酯的键线式结构简式为
;咖啡酸苯乙酯的键线式结构简式为 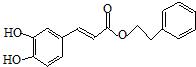 ,
, ;
;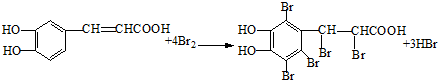 ,
,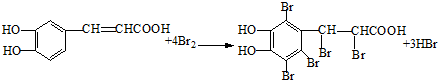 ;
; 的芳香化合物的结构为苯环上连有一个侧链为-COCH3或-CH2CHO,也可以是两个侧链为-CHO、-CH3,有邻间对三种,所以共有5种,故E正确;
的芳香化合物的结构为苯环上连有一个侧链为-COCH3或-CH2CHO,也可以是两个侧链为-CHO、-CH3,有邻间对三种,所以共有5种,故E正确; )与化合物Ⅱ也能发生反应①的反应,根据元素守恒可知其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,根据元素守恒可知其生成含羧基的化合物的结构简式为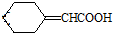 ,
, ;
;


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源: 题型:
| A、pH=1的溶液中:Fe2+、NO3-、Na+ |
| B、氨水中:Al3+、SO42-、Mg2+ |
| C、容器底部有硫粉:Fe3+、Cu2+、Cl- |
| D、NaNO3溶液中:Al3+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、Ba2+、Mg2+、ClO- |
| B、Cl-、SO42-、Cu2+、Mg2+ |
| C、Cl-、SO42-、K+、Na+ |
| D、HCO3-、NO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在水中溶解性:Na2CO3<NaHCO3 |
| B、热稳定性:Na2CO3>NaHCO3 |
| C、同浓度溶液与足量酸反应的速度:Na2CO3>NaHCO3 |
| D、将固体溶于少量水放出的热量:Na2CO3<NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
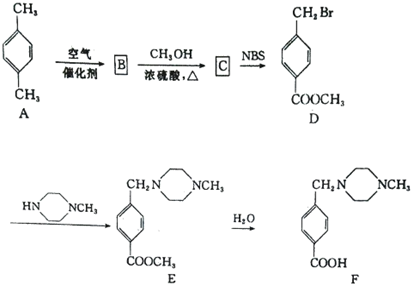
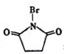 ,则反应C→D的化学方程式为
,则反应C→D的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HIO与HCN均为含有极性键的直线形极性分子 |
| B、SiO2与C02均为每摩含有4×6.02×1023对共用电子对的酸性氧化物 |
| C、Na2S浓溶液与稀盐酸分别滴加到饱和AgCl溶液中均一定有沉淀产生 |
| D、明矾与离子交换树脂均能将海水进行淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
| 电离平衡常数(25℃) | K=1.8×10-4 | K=5.1×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 | K1=5.4×10-2 K2=5.4×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com