
分析 (1)强电解质完全电离,用等号;
弱电解质,部分电离,用可逆号;
多元弱酸分步电离;多元弱碱,分步电离,书写时一步到位;
(2)含有弱根离子的盐溶于水后,弱根离子水解导致溶液呈现一定的酸碱性,阳离子水解导致溶液中氢离子浓度大于氢氧根离子浓度而使溶液呈酸性,酸根离子水解导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,注意多元弱酸根离子分步进行水解;
据此解答.
解答 解:(1)①醋酸为弱酸,液中部分电离,电离方程式用可逆符号,电离方程式为CH3COOH?H++CH3COO-,
故答案为:CH3COOH?H++CH3COO-;
②氢氧化铁为多元弱碱,分步电离,书写时一步到位,电离方程式:Fe(OH)3?Fe3++3OH-;
故答案为:Fe(OH)3?Fe3++3OH-;
③碳酸氢钾为弱酸的酸式盐,电离生成钾离子和碳酸氢根离子,电离方程式:KHCO3=K++HCO3-;
故答案为:KHCO3=K++HCO3-;
④硫酸氢钾,是强酸强碱酸式盐,属强电解质,完全电离,用等号,电离出K+、H+、SO42-离子,其电离方程式为KHSO4=K++H++SO42-,
故答案为:KHSO4=K++H++SO42-,
(2)①磷酸钠为强碱弱酸盐,水解的离子方程式:PO43-+H2O?HPO42-+OH-、HPO42-+H2O?H2PO4-+OH-、H2PO43-+H2O?H3PO4+OH-,
故答案为:PO43-+H2O?HPO42-+OH-、HPO42-+H2O?H2PO4-+OH-、H2PO43-+H2O?H3PO4+OH-;
②氯化铁为强酸弱碱盐,水解的离子方程式:Fe3++3H2O Fe(OH)3+3H+,故答案为:Fe3++3H2O Fe(OH)3+3H+;
③碳酸钾为强碱弱酸盐,水解的离子方程式:CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-;
④硫酸铜为强酸弱碱盐,水解的离子方程式:Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+;
⑤醋酸铵为弱酸弱碱盐,离子方程式:CH3COO-+NH4++H2O?CH3COOH+NH3•H2O,故答案为:CH3COO-+NH4++H2O?CH3COOH+NH3•H2O.
点评 本题考查了电解质电离方程式的书写、盐类水解方程式的书写,明确电解质的强弱、盐类的性质是解题关键,题目难度不大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
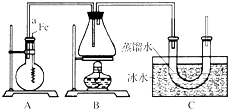 按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基(-OH)和氢氧根(OH-) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2?) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟甲基(-CH2OH)和甲氧基(CH3O-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)| 实验步骤 | 实验现象 |
| ①滴加入过量的稀盐酸 | 产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 | 产生白色沉淀. |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变,向平衡后的体系中加入1mol M,平衡向逆反应方向移动 | |
| B. | 其他条件不变,向平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动 | |
| C. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| D. | 用X表示此反应的反应速率是(0.1-0.2a)mol•L-1min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2 HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | Ba(OH)2溶液中滴入少量的NaHSO4溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 镁原子的核电荷数为12 | |
| B. | 镁原子的相对原子质量为24.31g | |
| C. | 镁属于非金属元素 | |
| D. | 在化学反应中,镁原子容易得到电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com