
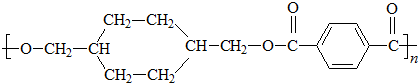
 、D
、D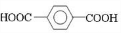 、E
、E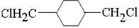 ;
;
 ;
; +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$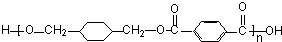 +(2n-1)H2O.
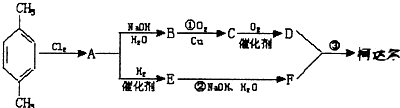
+(2n-1)H2O. 分析 由柯达尔的结构式可知,合成其单体为 、
、 ,A通过水解反应生成B,B氧化得到C,C继续被氧化得到D,则B的结构简式为
,A通过水解反应生成B,B氧化得到C,C继续被氧化得到D,则B的结构简式为 ,C为
,C为 ,D为
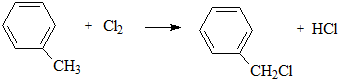
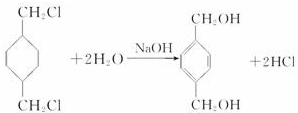
,D为 ,对二甲苯和氯气发生取代反应生成A为
,对二甲苯和氯气发生取代反应生成A为 ,A通过和氢气加成得到E,则E的结构简式为
,A通过和氢气加成得到E,则E的结构简式为 ,E水解得到F,故F为
,E水解得到F,故F为 ,据此解答.
,据此解答.
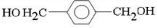
解答 解:(1)由上述分析可知,B的结构简式为 ,D为
,D为 ,E的结构简式为
,E的结构简式为 ,故答案为:
,故答案为: ;
; ;
; ;
;
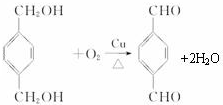
(2)B→C的反应方程式为: ,
,
E→F的反应方程式为: ;
;
D+F→柯达尔的反应方程式为: +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$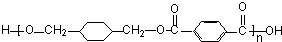 +(2n-1)H2O,
+(2n-1)H2O,
故答案为: ;
; ;
; +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$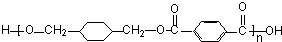 +(2n-1)H2O.
+(2n-1)H2O.
点评 本题考查有机物推断,注意利用柯达尔的结构式确定其单体,结合反应条件,利用逆推法推断,需要学生熟练掌握官能团的性质与转化,难度中等.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
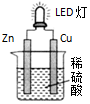
| A. | 锌是负极,电子从锌片经导线流向铜片 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 锌质量减少65g时,铜电极表面析出氢气是22.4L | |
| D. | 装置中存在“化学能→电能→光能”的转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
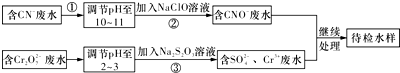
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
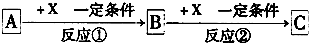
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
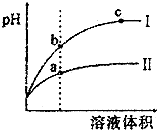 2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )
2011年8月,多家媒体报道部分山西老陈醋是由醋精勾兑而成,醋精就是冰醋酸.专家介绍,只要是符合国家标准的勾兑醋,是可以放心食用的.下列关于醋酸的说法中正确的是( )| A. | 0.01mol•L-l的醋酸溶液的Ph=2 | |
| B. | 向某温度下的醋酸溶液中通入HCl气体,醋酸的电离常数Ka会增大 | |
| C. | 等pH的盐酸与醋酸稀释后pH的变化如图所示,则曲线Ⅰ表示的是盐酸的稀释图象溶液体积 | |
| D. | 图中,a、b、c三点表示的溶液的导电性强弱关系为a<b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A-B之前 | B. | B-C间 | C. | C-D间 | D. | D-E间 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
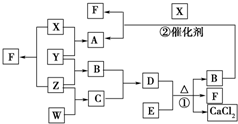 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
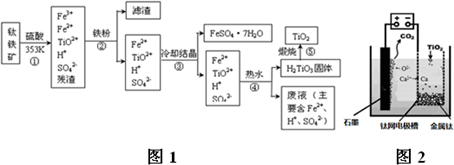
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com