
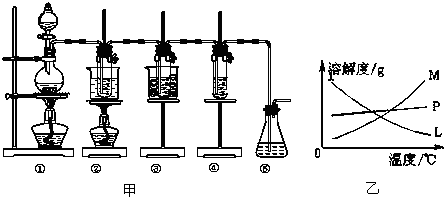
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成次氯酸具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
分析 (1)向烧瓶中加入浓盐酸应该使用分液漏斗;浓盐酸与二氧化锰在加热条件下发生反应生成氯气和氯化锰和水;浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水,而氯气在饱和食盐水中溶解度不大,据此选择合适的除杂试剂;
(2)只有浓盐酸才能被二氧化锰氧化,稀盐酸与浓盐酸不反应,浓盐酸易挥发,且反应不断消耗浓盐酸,使得盐酸的浓度降低;
(3)氯气与氢氧化钠或者氢氧化钾的反应中,温度与浓度对化学反应产物有很大影响;冷却后,②的试管中有大量晶体析出,则其溶解度受温度影响较大,且随温度升高而增大;固体与溶液的分离为过滤;
(4)根据氯气的性质和氯水的成分考虑.
解答 解:(1)向烧瓶中加入浓盐酸应该使用分液漏斗;浓盐酸与二氧化锰在加热条件下发生反应生成氯气和氯化锰和水,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;制取氯气时需要加热,浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水,而氯气在饱和食盐水中溶解度不大,可以使用饱和食盐水,既除去HCl又降低氯气在水中的溶解度,即选用C;
故答案为:分液漏斗;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;C;
(2)只有浓盐酸才能被二氧化锰氧化,稀盐酸与浓盐酸不反应,20mL 12mol•L-1的浓盐酸含氯化氢的物质的量为0.2L×12mol/L═2.4mol,根据化学方程式:MnO2+4HCl=MnCl2+Cl2+2H2O可知:在二氧化锰过量的条件下,如果HCl完全反应,会生成氯气0.6mol,但是因为盐酸易挥发,且反应不断消耗浓盐酸,使得盐酸的浓度降低,变为稀盐酸,不再与二氧化锰发生反应,所以实际生成氯气物质的量小于0.6mol;
故答案为:浓盐酸挥发变稀;反应一段时间后,浓盐酸消耗变稀,无法被二氧化锰氧化;
(3)制取氯酸钾和次氯酸钠的条件有两个不同点:①制取温度不同,制取制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度;②制取时碱的浓度也不同,取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱;
冷却后,②的试管中有大量晶体析出,则其溶解度受温度影响较大,且随温度升高而增大,则曲线M符合,固体与溶液的分离为过滤;
故答案为:①制取温度不同,制取氯酸钾需要较高温度,制取次氯酸钠需要较低温度;
②制取时,碱的浓度也不同,制取氯酸钾需要浓度较大的碱,制取次氯酸钠需要浓度较小的碱;
M;过滤;
(4)氯气通入紫色石蕊试液,由于氯气与水反应,即Cl2+H2O=Cl-+H++HClO,由于反应生成盐酸,所以氯水显酸性,则氯水能使紫色石蕊试液变成红色,而后由于氯水中存在次氯酸,次氯酸具有漂白性,可以使红色石蕊试液退成无色,后来,由于氯气继续通入溶液,通入的氯气不再继续表现氧化性,而是要溶解在水中,最终形成氯水,其颜色呈现黄绿色或浅黄绿色;
故答案为:
| 实验现象 | 原因 |
| 红 | |
| 氯气与水反应生成HClO具有漂白性 | |
| 浅黄绿 | 过量氯气溶解于水中 |
点评 本题为综合题,考查了氯气的实验室制法、氯气的性质、氯水的性质等,侧重考查学生结合已有知识与题给信息解题的能力,题目难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com