
 .
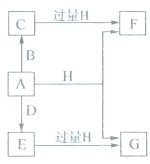
.分析 A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,则A为S;B、D是气体,均匀硫单质反应,为D与硫反应生成的E有漂白性,则D为O2,E为SO2.F、G、H的焰色反应均为黄色,均含有Na元素,水溶液均显碱性,结合转化关系可知,H为NaOH、G为Na2SO3,F为Na2S,B为H2,C为H2S,据此解答.
解答 解:A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,则A为S;B、D是气体,均匀硫单质反应,为D与硫反应生成的E有漂白性,则D为O2,E为SO2.F、G、H的焰色反应均为黄色,均含有Na元素,水溶液均显碱性,结合转化关系可知,H为NaOH、G为Na2SO3,F为Na2S,B为H2,C为H2S.
(1)A为硫,硫元素处于第三周期第ⅥA族,C为H2S,电子式为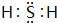 ,
,
故答案为:第三周期第ⅥA族;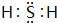 ;
;
(2)硫与NaOH溶液在加热条件下反应的化学方程式为:3S+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2S+Na2SO3+3H2O,
故答案为:3S+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$ 2Na2S+Na2SO3+3H2O;
(3)25℃时,pH均为10的NaOH和Na2SO3溶液,NaOH溶液中水电离出的c(OH-)=10-10mol/L,Na2SO3溶液中由水电离出的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4mol/L,二者溶液中由水电离出的c(OH-)之比为-)=10-10mol/L:10-4mol/L=1:106,
故答案为:1:106;
(4)将S溶于沸腾的Na2SO3溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的S和SO2,则I为Na2S2O3,Na2S2O3在酸性条件下生成硫和二氧化硫的离子方程式为:2H++S2O32-═S↓+SO2↑+H2O;
Na2S2O3是中强还原剂,向Na2S2O3溶液中通入氯气可发生反应,参加反应的Na2S2O3和氯气的物质的量比为1:4,Cl元素被还原为-1价,设S元素在氧化产物中化合价为a,根据电子转移守恒:2(a-2)=4×2,解得a=6,故氧化得到SO42-,该反应的离子方程式为:4Cl2+S2O32-+5H2O═8Cl-+2SO42-+10H+,
故答案为:2H++S2O32-═S↓+SO2↑+H2O;4Cl2+S2O32-+5H2O═8Cl-+2SO42-+10H+;
(5)向含有0.4mol Na2S、0.1mol Na2SO3的混合溶液中加入过量盐酸,发生反应:2S2-+SO32-+6H+=3S↓+3H2O,0.1mol Na2SO3反应消耗0.2mol Na2S,剩余0.2mol Na2S,再发生反应:S2-+2H+=H2S↑,得到0.2molH2S,取反应后的澄清溶液,加入氯化铁,得到沉淀3.2g,说明溶液中溶解硫化氢,发生反应:2Fe3++H2S=2Fe2++S↓+2H+,生成S为$\frac{3.2g}{32g/mol}$=0.1mol,故溶液中溶解硫化氢为0.1mol,则从溶液中逸出的气体体积为(0.2mol-0.1mol)×22.4L/mol=2.24L,
故答案为:2.24.
点评 本题考查无机物推断,焰色反应及特殊反应为推断突破口,需要学生熟练掌握元素化合物的性质,(5)中计算为易错点、难点,学生容易认为混合物与盐酸反应得到硫化氢完全逸出,忽略溶液中溶解硫化氢.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝、碳酸钠都是常见的胃酸中和剂 | |
| B. | 长期摄入肉、蛋、鱼偏多易导致血液偏酸性 | |
| C. | 碘酒中的碘因有还原性而起到杀菌消毒作用 | |
| D. | 碘盐、铁强化酱油等营养强化剂适合所有人食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaAlO2溶液中:H+、Na+、Cl-、SO3- | |
| B. | 无色溶液中:K+、Ca2+、Cl-、NO3- | |
| C. | 使酚酞变红色的溶液中:Na+、Cu2+、HCO3-、NO3- | |
| D. | 使石蕊变红的溶液中:H+、Na+、Fe2+、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
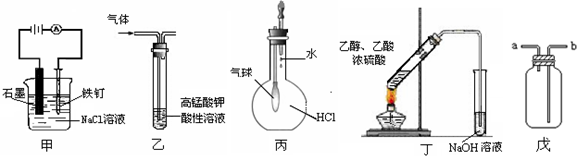
| A. | ①⑤ | B. | ②④ | C. | ③④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该温度下NaHSO3 的水解平衡常数Kh=1×10-2 | |
| B. | 若向NaHSO3 溶液中加入少量的I2,则溶液中$\frac{c{(H}_{2}{SO}_{3})}{c(HS{O}_{3}^{-})}$ 将减小 | |
| C. | 略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大 | |
| D. | NaHSO3溶液中:c(H+)<c(S${O}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl | |
| B. | 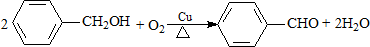 | |
| C. | 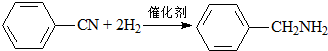 | |
| D. | 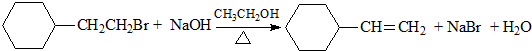 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com