
【题目】(1)最近有人利用反应“2C4H10+13O2=8CO2+10H2O”制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
固体电解质中的O2-向 极移动(填“正”或“负”);写出该燃料电池的电极反应式:电池正极 ;电池负极 。
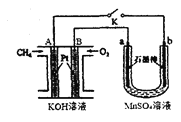
(2)用如图装置电解MnSO4溶液制MnO2时,A极为: 极, A电极电极反应式为 ;a极为: 极,电解MnSO4溶液制MnO2的化学方程式 。电解一段时间后, 溶液的pH将 (填“增大”、“减小”或“不变”)。
(3)精炼铜时,粗铜应与直流电源的____________极(填“正”或“负”)相连,阴极的电极反应式为 。
【答案】(1)负(1分)13O2+52e-26O2-(2分)
2C4H10+26O2--52e-8CO2+10H2O(2分)
(2)负(1分),CH4+10OH--8e-===CO![]() +7H2O(2分)正极(1分)
+7H2O(2分)正极(1分)
MnSO4+H2O=MnO2+H2+H2SO4(条件通电)(2分)减小(1分)
(3)正(1分)Cu2++2e=Cu(2分)
【解析】
试题解析:丁烷的燃料电池属于原电池,丁烷做负极;发生氧化反应:C4H10+34OH--26e-===4CO![]() +22H2O;氧气在正极发生还原反应,13O2+52e- 26O2-;固体电解质中的O2-向负极移动;(2)原电池:通入甲烷为负极,发生氧化反应:CH4+10OH--8e-===CO
+22H2O;氧气在正极发生还原反应,13O2+52e- 26O2-;固体电解质中的O2-向负极移动;(2)原电池:通入甲烷为负极,发生氧化反应:CH4+10OH--8e-===CO![]() +7H2O;电解池,a 为阳极;发生氧化反应:电解Mn2+--2e-+ 2H2O = MnO2+4H+;电解MnSO4溶液制MnO2的化学方程MnSO4+H2O=MnO2+H2+H2SO4 反应产生了硫酸,氢离子浓度增大,酸性增强,pH将变小;(3)精炼铜时,粗铜应与直流电源的正极相连,发生氧化反应,纯铜作阴极,发生还原反应:Cu2++ 2e = Cu;
+7H2O;电解池,a 为阳极;发生氧化反应:电解Mn2+--2e-+ 2H2O = MnO2+4H+;电解MnSO4溶液制MnO2的化学方程MnSO4+H2O=MnO2+H2+H2SO4 反应产生了硫酸,氢离子浓度增大,酸性增强,pH将变小;(3)精炼铜时,粗铜应与直流电源的正极相连,发生氧化反应,纯铜作阴极,发生还原反应:Cu2++ 2e = Cu;
考点:燃料电池、电解池相关知识考察。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】已知c(NH4Cl)≤0.1mol/L时,溶液pH>5.1。现用0.1 mol/L盐酸滴定10mL0.05 mol/L氨水,用甲基橙作指示剂,达到滴定终点,所用盐酸的体积为
A. 10mL B. 5mL C. 大于5 mL D. 小于5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
实验:向2 mL FeCl2溶液中滴加2滴0.1 molL-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 molL-1、pH约为5(酸性环境)),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示实验中溶液变红的原因: 、 。
(2)甲探究实验中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 molL-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
① 实验I说明 ;②实验III说明 。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法中不正确的是
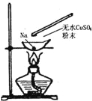
A.上述反应是置换反应
B.上述反应是放热反应
C.上述反应中CuSO4表现了还原性
D.加热且无水条件下,Na可以与CuSO4反应并生成Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.最外层有2个电子的原子都是金属原子
B.除短周期外,其他周期均有18个元素
C.副族元素中没有非金属元素
D.碱金属元素是指IA族的所有元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,8.25 g气体X所占的体积和6 g O2所占的体积相同,则X的相对分子质量是
A. 22 B. 44 C. 28.25 D. 88
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种物质,只有在加热的条件下才能反应并产生气体的是( )
A.Cu+H2SO4(稀)
B.Cu+HNO3(浓)
C.Fe+HNO3(稀)
D.C+H2SO4(浓)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氧化镁、氧化铝的混合物完全溶于200 mL盐酸,而后逐滴加入1.0 mol·L-1的NaOH溶液。溶液中生成沉淀的物质的量随加入的NaOH的溶液体积的变化,如图所示。
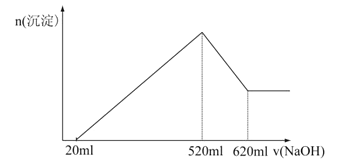
(1)试说明最初加入的20 mL NaOH溶液的作用。
(2)求所用盐酸的物质的量浓度。
(3)求氧化镁、氧化铝物质的量之比。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com