
| A. | 实验室制取蒸馏水和用海水晒盐都利用了相同的物质分离方法 | |
| B. | 往盛有少量淀粉溶液的试管中加入一定量稀硫酸,加热3~4分钟后,再加入NaOH溶液至碱性,最后加入银氨溶液并水浴加热,有“银镜”出现 | |
| C. | 受强碱腐蚀致伤时,应先用大量水冲洗,再用2%的醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| D. | 采用比色的方法测定溶液颜色的深浅,根据溶液颜色与反应物浓度的关系,可换算成反应物在不同反应时刻的浓度 |
分析 A、实验室制取蒸馏水是蒸馏法,而海水晒盐是结晶的分离方法;
B、淀粉水解生产葡萄糖,调溶液至碱性,最后加入银氨溶液并水浴加热既有“银镜”出现;
C、强碱腐蚀致伤时,应先用大量水冲洗,再用2%的醋酸溶液或饱和硼酸溶液洗;
D、采用比色的方法测定溶液颜色的深浅,根据溶液颜色与反应物浓度的关系,颜色深浓度大.
解答 解:A、实验室制取蒸馏水是蒸馏法,而海水晒盐是结晶的分离方法,故A错误;
B、淀粉溶液的试管中加入一定量稀硫酸,加热3~4分钟后,发生水解生产葡萄糖,再加入NaOH溶液至碱性,最后加入银氨溶液并水浴加热,有“银镜”出现,故B正确;
C、强碱腐蚀致伤时,应先用大量水冲洗,再用2%的醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况去医院处理,故C正确;
D、采用比色的方法测定溶液颜色的深浅,根据溶液颜色与反应物浓度的关系,颜色深浓度大,即可换算成反应物在不同反应时刻的浓度,故D正确;
故选A.
点评 本题考查物质的分离,银镜实验,强碱腐蚀的处理,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
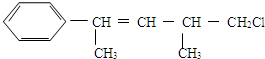
| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和4 molH2反应 | |
| D. | 一定条件下,能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:X>Y>Z>W | |
| B. | Y的气态氢化物的热稳定性比W的强 | |
| C. | 原子半径的大小顺序:r(Z)>r(Y)>r(W)>r(X) | |
| D. | X分别与Y、Z形成的化合物中化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作及现象 | 实验结论 | |
| A | 将SO2通入品红溶液中,红色逐渐褪去;再加热已褪色的溶液,溶液又恢复为红色 | 生成的亚硫酸不稳定 |
| B | 向某盐溶液中加入浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色 | 原溶液中含有NH+4 |
| C | 在某硝酸盐溶液中加入少量稀H2SO4,酸化,再滴加几滴KSCN溶液,溶液变红色 | 原硝酸盐为Fe(NO3)3 |
| D | 将淀粉液和稀硫酸混合微热:一段时间后加入银氨溶液,振荡,水溶加热,试管内壁未出现银镜 | 淀粉一定尚未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com