
【题目】写出下列有机物的系统命名或结构简式:
(1)CH3CH(CH3)C(CH3)2(CH2)2CH3
(2)2﹣甲基﹣2﹣戊醇
(3)![]()
(4) .
.
【答案】
(1)2,3,3﹣三甲基己烷
(2)CH3C(OH)CH3(CH2)2CH3
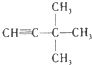
(3)4﹣甲基﹣3﹣乙基﹣2﹣己烯
(4)3,3﹣二甲基﹣1﹣丁炔
(5 ) ![]() ?????? .
?????? .
C8H14
【解析】解:(1)烷烃命名时,要选最长的碳链为主链,故主链上有6个碳原子,从离支链近的一端给主链上碳原子编号,故在2号碳原子上有一个甲基,在3号碳原子上有2个甲基,故名称为:2,3,3﹣三甲基己烷,所以答案是:2,3,3﹣三甲基己烷;(2)2﹣甲基﹣2﹣戊醇即最长碳链含有5个碳,在2号碳上含有羟基,在2号碳上含1个甲基,故依据命名正确结构简式是:CH3C(OH)CH3(CH2)2CH3 , 所以答案是:CH3C(OH)CH3(CH2)2CH3;(3)从距碳碳双键最近的一端编号, ![]() 最长碳链含有6个碳,在2号碳上含有碳碳双键,在4号碳上含1个甲基,在3号碳上含1个乙基,名称为:4﹣甲基﹣3﹣乙基﹣2﹣己烯,所以答案是:4﹣甲基﹣3﹣乙基﹣2﹣己烯;(4)从距碳碳叁键最近的一端编号,
最长碳链含有6个碳,在2号碳上含有碳碳双键,在4号碳上含1个甲基,在3号碳上含1个乙基,名称为:4﹣甲基﹣3﹣乙基﹣2﹣己烯,所以答案是:4﹣甲基﹣3﹣乙基﹣2﹣己烯;(4)从距碳碳叁键最近的一端编号, 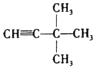 最长碳链含有4个碳,在1号碳上含有碳碳叁键,在3号碳上含2个甲基,名称为:3,3﹣二甲基﹣1﹣丁炔,所以答案是:3,3﹣二甲基﹣1﹣丁炔;(5)在键线式中,端点和拐点代表碳原子,故有8个碳原子,根据二烯烃的通式为CnH2n﹣2可知分子式为C8H14 , 所以答案是:C8H14 .
最长碳链含有4个碳,在1号碳上含有碳碳叁键,在3号碳上含2个甲基,名称为:3,3﹣二甲基﹣1﹣丁炔,所以答案是:3,3﹣二甲基﹣1﹣丁炔;(5)在键线式中,端点和拐点代表碳原子,故有8个碳原子,根据二烯烃的通式为CnH2n﹣2可知分子式为C8H14 , 所以答案是:C8H14 .


科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )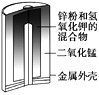
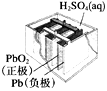
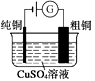
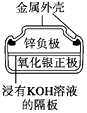
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A.图1所示电池中,MnO2的作用是催化剂
B.图2所示电池放电过程中,硫酸浓度不断增大
C.图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是(填“增大”“减小”或“不变”,下同),ΔH的变化是。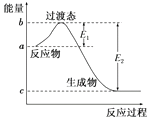
(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1 , 则甲醇蒸气燃烧为液态水的热化学方程式为。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO 。这两步的能量变化如图: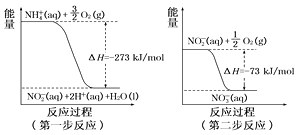
第二步反应是反应(填“放热”或“吸热”)。1 mol NH4+(aq)全部氧化成NO (aq)的热化学方程式是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为中符合安全要求的是
A. 进入煤矿使用火把照明
B. 节日期间,在开阔的广场燃放烟花爆竹
C. 用点燃的火柴在液化汽钢瓶口检验是否漏气
D. 实验时,将水倒入浓硫酸配制稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是( )
A.硅在化学反应中易得到电子B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片D.光导纤维的主要成分是Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理分析解答以下问题
(1)已知:①CO(g)+2H2(g)CH3OH(g)△Hl=﹣91kJmol﹣l
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣24kJmol﹣l
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41kJmol﹣l
且三个反应的平衡常数依次为K1、K2、K3
则反应 3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H= .
化学平衡常数K=(用含K1、K2、K3的代数式表示).
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),下列能说明反应达到平衡状态是 .
a.体系压强保持不变
b.混合气体密度保持不变
c.CO和H2的物质的量保持不变
d.CO的消耗速度等于CO2的生成速率
(3)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3 . 其电池反应式为:4NH3+3O2=2N2+6H2O,电解质溶液应显(填“酸性”、“中性”、“碱性”),写出正极的电极反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:
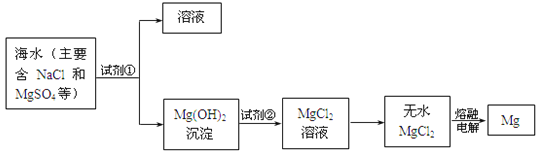
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用_________;
(2)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为__________________;
(3)电解后产生的副产物氯气可用于工业制漂白粉。某兴趣小组模拟工业制漂白粉,设计了下图的实验装置。
已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
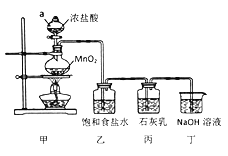
回答下列问题:
①甲装置中仪器a的名称是____________________;
②装置乙中饱和食盐水的作用是__________________________________;
③制取漂白粉的化学方程式是_____________________________________;
④该小组制得的漂白粉中n(CaCl2)远大于n(Ca(ClO)2],其主要原因是_________;
⑤为提高丙中Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com