
| 已电离的醋酸分子 |
| 醋酸分子总数 |
| C(H+).C(CH3COO-) |
| C(CH3COOH) |
| 已电离的醋酸分子 |
| 醋酸分子总数 |
| 1×10-3mol/L |
| 0.1mol/L |
| C(H+).C(CH3COO-) |
| C(CH3COOH) |
| 0.001×0.001 |
| 0.1 |


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
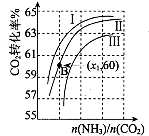 用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g).工业生产时,原料气带有水蒸气.图表示CO2的转化率与氨碳比
用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g).工业生产时,原料气带有水蒸气.图表示CO2的转化率与氨碳比| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何温度下都能自发进行 |
| B、在任何温度下都不能自发进行 |
| C、仅在高温下自发进行 |
| D、仅在低温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com