
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、基准试剂、还原剂、除氯剂等。
Ⅰ、实验室制备硫代硫酸钠装置图如下。

(1)仪器B的名称是________。
(2)写出装置B制备Na2S2O3的化学反应方程式____________________________。
(3)NaOH溶液的作用是____________________________________。
Ⅱ、测硫代硫酸钠样品纯度步骤如下
①称取Ⅰ中制得硫代硫酸钠样品8.0g配成250mL溶液
②从①中量取20.00mL溶液于锥形瓶中
③用0.lmol·L-1标准碘液滴定,实验测得数据如下
滴定前读数(mL) | 滴定后读数(mL) | 待测液体积(mL) | |
实验一 | 1.20 | 21.00 | 20.00 |
实验二 | 0.40 | 19.20 | 20.00 |
实验三 | 0.50 | x | 20.00 |
(4)该滴定时,向锥形瓶中加入1至2滴淀粉液作指示剂,则达到滴定终点的判断标准是______________。
(5)x读数如图所示,则x=________,根据所测的数据计算该硫代硫酸钠样品纯度为_______________。(已知I2+2Na2S2O3=2NaI+Na2S4O6)

(6)若步骤①中量取20.00mL硫代硫酸钠溶液时,未用硫代硫酸钠溶液润洗滴定管,则测得样品的纯度将______________(填“偏大”或“偏小”)。
【答案】三颈烧瓶 2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2 吸收多余的SO2 滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色 20.70 98.75%或98.8% 偏小
【解析】
Ⅰ、(1)依据仪器构造作答;
(2)装置A中制备出的二氧化硫通入装置B中,此装置硫化钠与碳酸钠和通入的二氧化硫发生氧化还原反应生硫代硫酸钠,根据氧化还原反应规律与质量守恒定律书写其化学方程式;
(3)氢氧化钠可吸收二氧化硫;
Ⅱ、(4)淀粉溶液遇碘单质变蓝,据此分析;
(5)滴定管读数时,凹液面的最低处与刻度线相切,且要估读一位;根据实验数据得出消耗的碘液的体积,结合关系式I2~2S2O32-,得出样品中S2O32-的物质的量,进而计算样品的纯度;
(6)依据滴定实验操作不当可能带来的误差分析结果。
Ⅰ、(1)仪器B的名称为三颈烧瓶,
故答案为:三颈烧瓶;
(2)在装置B中利用Na2S、Na2CO3与SO2制备Na2S2O3,此反应为氧化还原反应,-2价的S元素升高到+2价,+4价的S元素降低到+2价,依据氧化还原反应规律配平该化学方程式为:2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2,
故答案为:2Na2S+Na2CO3+4SO2 =3Na2S2O3+CO2;
(3)NaOH溶液可吸收多余的SO2,防止污染环境,
故答案为:吸收多余的SO2;
Ⅱ、(4)根据给定的已知反应I2+2Na2S2O3=2NaI+Na2S4O6可知,硫代硫酸钠会使碘单质变成碘离子,则滴定时向锥形瓶中加入1至2滴淀粉液作指示剂,当滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色,则证明达到滴定终点,
故答案为:滴加最后一滴标准液后,溶液由无色变为蓝色且半分钟内不变色;
(5)根据滴定管的读数规则可知,实验三滴定后读数为20.70mL,则三次实验得出消耗的标准碘液的体积分别为21.00 mL -1.20 mL =19.80mL、19.20 mL -0.40mL =18.80mL、20.70 mL -0.50 mL =20.20 mL,则可以看出第二实验误差太大,实验数据应该舍去,由此可知消耗的碘液的体积平均值为=![]() ,结合化学方程式,根据关系式I2~2S2O32-可得,则配制的20mL样品溶液中硫代硫酸钠的物质的量n=2n(I2)= 2×0.lmol·L-1×20.00×10-3L=4.00×10-3 mol,则原样品中含有的硫代硫酸钠的物质的量为4.00×10-3 mol ×
,结合化学方程式,根据关系式I2~2S2O32-可得,则配制的20mL样品溶液中硫代硫酸钠的物质的量n=2n(I2)= 2×0.lmol·L-1×20.00×10-3L=4.00×10-3 mol,则原样品中含有的硫代硫酸钠的物质的量为4.00×10-3 mol ×![]() =5×10-2 mol,所以样品纯度为
=5×10-2 mol,所以样品纯度为![]() ,
,
故答案为:20.70;98.75%或98.8%;
(6)待测的滴定管未用硫代硫酸钠溶液润洗,会使锥形瓶内待测液浓度偏低,消耗的碘液体积偏小,最终导致样品纯度偏小,
故答案为:偏小。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有原子序数小于20的A,B,C,D,E,F6种元素,它们的原子序数依次增大,已知B元素是地壳中含量最多的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B,D两元素原子核内质子数之和的1/2;C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。回答下列问题。
(1)用电子式表示C和E形成化合物的过程________________。
(2)写出基态F原子核外电子排布式__________________。
(3)写出A2D的电子式________,其分子中________(填“含”或“不含”)σ键,________(填“含”或“不含”)π键。
(4)A,B,C共同形成的化合物化学式为________,其中化学键的类型有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Fe2O3+2Al![]() 2Fe+Al2O3 所属基本反应类型是_______________。
2Fe+Al2O3 所属基本反应类型是_______________。
(2)在该反应中_______(填写元素名称)元素的化合价升高,该元素的原子______电子,被________;而_______(填写元素名称)元素的化合价降低,该元素的原子_______电子,被_________。
(3)该反应中,Fe2O3发生了_______反应,Al发生了________反应,_______是氧化剂_________________是还原剂,__________是氧化产物,________是还原产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列四种粒子中,半径按由大到小的排列顺序是____________(填序号)。
①基态X的原子结构示意图:![]()
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图:![]()
④W基态原子有2个能层,电子式为![]()
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是______________,离子半径由大到小的顺序是________________,原子序数由大到小的顺序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构模型的演变图如右,下列符合历史演变顺序的一组排列是

A. (1)(3)(2)(4) B. (1)(2)(3)(4)
C. (1)(4)(3)(2) D. (1)(3)(4)(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示。

已知:
回答下列问题:
(1)化合物C中的含氧官能团名称为_________,A到B的反应类型为__________。
(2)A的名称为____________
(3)写出D的结构简式:_____________________________。
(4)写出反应②的化学方程式:____________________________________________。
(5)化合物C满足下列条件的同分异构体有_______种,写出其中一种有5种不同种类氢原子的同分异构体的结构简式:_______________。
①含苯环结构,能在碱性条件下发生水解;
②能与FeCl3发生显色反应;
③能发生银镜反应。
(6)已知CH3CH2CN![]() CH3CH2COOH。请以
CH3CH2COOH。请以 、CH2=CHCN和乙醇为原料合成化合物
、CH2=CHCN和乙醇为原料合成化合物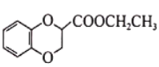 ,写出制备的合成路线流程图(无机试剂任用)____________________
,写出制备的合成路线流程图(无机试剂任用)____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。其总反应方程式为: xLi + Li1-xMn2O4 ![]() LiMn2O4下列叙述错误的是
LiMn2O4下列叙述错误的是

A. a为电池的正极
B. 放电时,溶液中Li+从b向a迁移
C. 充电时,外接电源的负极与b相连
D. 可用Na2SO4溶液代替Li2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。

请回答下列问题:
(1) NaOH的电子式为__________________。
(2) G的化学式为______________________。
(3) 写出反应④的离子方程式:________________________________________________。
(4) 写出反应⑥的化学方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀H2C2O4溶液中滴加等浓度NaOH溶液,H2C2O4、HC2O4—、C2O42—的浓度分数δ随溶液pH变化的关系如图,以下说法正确的是( )

A. HC2O4—的浓度分数随pH增大而增大
B. 交点a处对应加入的NaOH溶液的体积为5mL
C. 交点b处c(H+)=6.4×10-5
D. pH=5时存在c(Na+)+c(H+)=c(C2O42—)+c(HC2O4—)+c(OH—)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com