
运用化学反应原理知识在工业生产中有重要意义。
(1) 工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
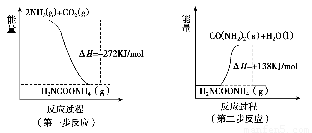
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为___________?????????? _____。
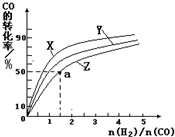
(2)工业生产中用CO可以合成甲醇CO(g)+2H2(g)  CH3OH(g),ΔH=-90.1 kJ·mol-1??? 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1??? 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
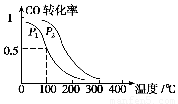
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_????????? ____(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(3)工业生产中用SO2为原料制取硫酸
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式___???????????????? ____________。
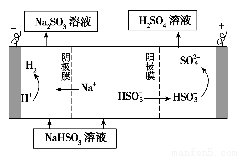
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式____?????????? ______。
(4)工业生产中用氨水吸收SO2
若将等物质的量的SO2与NH3溶于水充分反应,写出该反应的离子方程式??????? ,所得溶液呈??????? 性。
(1)2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=-134 kJ·mol-1
(2)①小于 ②(V/a)2 ③增大??
(3)①SO2+2H2O-2e-=4H++SO42-???? ②HSO3-+H2O-2e-=SO42-+3H+
(4)SO2 + N H3+H2O= N H4++HSO3—? 酸性(1分)
【解析】
试题分析:(1)由图示可知,两步反应的完成的热效应与一步完成的热效应是相同的,将两个反应相加可得2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=-134 kJ·mol-1。
(2)①根据化学方程式CO(g)+2H2(g)  CH3OH(g),正反应方向为气体系数减小的方向,所以增大压强,化学平衡向右移动,CO的转化率增大,所以p1小于p2。
CH3OH(g),正反应方向为气体系数减小的方向,所以增大压强,化学平衡向右移动,CO的转化率增大,所以p1小于p2。
②根据“三段式”进行计算,CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
初始浓度(mol?L?1)??? a/V???? 2a/V??????? 0
转化浓度(mol?L?1)??? a/2V??? a/V???????? a/2V
平衡浓度(mol?L?1)??? a/2V??? a/V? ?????? a/2V
所以K=a/2V÷[a/2V×(a/V)2]= (V/a)2
在其它条件不变的情况下,再增加a mol CO和2a molH2,容器内压强增大,平衡向右移动,CO的转化率增大。
(3)①原电池负极发生氧化反应,SO2失去电子生成SO42?,配平得电极方程式:SO2+2H2O-2e-=4H++SO42-
②HSO3?在电解池的阳极发生氧化反应,失去电子转化为SO42?:HSO3-+H2O-2e-=SO42-+3H+
(4)等物质的量的SO2与NH3溶于水充分反应,生成NH4HSO3,离子方程式为:SO2 +??????????????????? N H3+H2O=NH4++HSO3—? ,NH4HSO3为酸式盐,在溶液中电离出H+,使溶液显酸性。
考点:本题考查热化学方程式的书写、化学平衡的移动及计算、原电池及电解池原理、方程式的书写。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2015届江苏省常州市高二化学期末模测化学试卷一(解析版) 题型:填空题
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+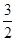 O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+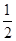 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+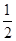 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g)  CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
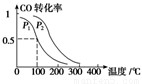
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
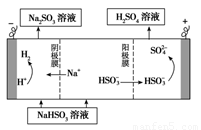
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省潍坊市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
① CH3OH(g)+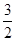 O2(g)=CO2(g)+2H2O(l)
△H=-764.5kJ/mol
O2(g)=CO2(g)+2H2O(l)
△H=-764.5kJ/mol
② CO(g)+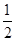 O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③ H2(g)+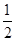 O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
则CO(g)+2H2(g)=CH3OH(g) △H=__________kJ/mol
(2)下列措施中能够增大上述合成甲醇反应的速率的是_________(填写序号)。
a.使用高效催化剂
b.降低反应温度
c.增大体系压强
d.不断将CH3OH从反应混合物中分离出来
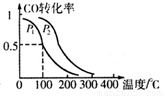
(3)在一定压强下,容积为VL的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示
 。
。
① P1_________P2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=_________(mol L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”、或“不变”)
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式__________。
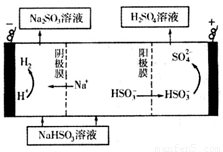
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如右图所示。请写出开始时阳极反应的电极反应式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com