
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2| 温度 | 250 ℃ | 300 ℃ | 350 ℃ |
| K | 2.041 | 0.270 | 0.012 |
 CH3OH(g) 原子的利用率为100%,反应Ⅱ:CO2(g)+3H2(g)
CH3OH(g) 原子的利用率为100%,反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)有副产物水生成,符合“原子经济”原则的是Ⅰ;②分析题给数据知,随着温度的升高,化学平衡常数逐渐减小,平衡逆向移动,升高温度,平衡向吸热反应方向移动,故反应Ⅰ为放热反应,ΔH1<0;③平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率= n(CO)(反应)/ n(CO)(起始)×100%=(2—0.4)mol/2mol×100%=80%;
CH3OH(g)+H2O(g)有副产物水生成,符合“原子经济”原则的是Ⅰ;②分析题给数据知,随着温度的升高,化学平衡常数逐渐减小,平衡逆向移动,升高温度,平衡向吸热反应方向移动,故反应Ⅰ为放热反应,ΔH1<0;③平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率= n(CO)(反应)/ n(CO)(起始)×100%=(2—0.4)mol/2mol×100%=80%; CH3OH(g)
CH3OH(g)

科目:高中化学 来源:不详 题型:单选题
| A.植物光合作用时,太阳能转化为化学能 |
| B.电解水生成氢气和氧气时,电能转化为化学能 |
| C.白炽灯工作时,电能全部转化为光能 |
| D.垃圾处理厂可将生活垃圾中的生物质能转化为热能、电能等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.煤燃烧时可将全部化学能转化为热能 |
| B.电解熔融Al2O3时将部分化学能转化为电能 |
| C.氢氧燃料电池能量转化效率高,可将全部化学能转化为电能 |
| D.镁条燃烧时将部分化学能转化为光能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ?pC(g)+2D(g),生成0.5 mol D,又知C的平均反应速率是0.1 mol/(L·s),则下列说法中正确的是
?pC(g)+2D(g),生成0.5 mol D,又知C的平均反应速率是0.1 mol/(L·s),则下列说法中正确的是| A.①② | B.②③ | C.③④ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
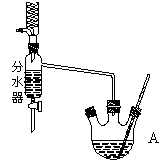
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 实验测得不同温度下的平衡数据列于下表:
实验测得不同温度下的平衡数据列于下表:
| A.2v(NH3)=v(C02) | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
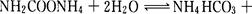
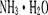 该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到C(NH2C00-)随时间的变化趋势如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应速率表示的是化学反应进行的限度 |
| B.化学反应速率可以用单位时间内反应物浓度的减少量来表示 |
| C.对于任何化学反应来说,反应速率越快,反应现象就越明显 |
| D.化学反应速率可以是正值,也可以是负值 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
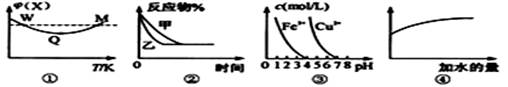
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)  3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 |
B.图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强小 3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D.常温下,稀释0.1mol/LNa2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com