
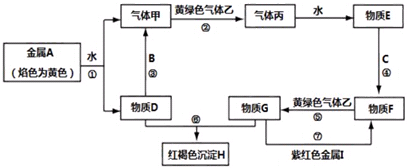
分析 金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;B是地壳中含量最多的金属,氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.金属C与盐酸反应得到F,F与氯气反应得到G,G与氢氧化钠与得到红褐色沉淀H,则C为Fe,F为FeCl2,G为FeCl3,H为Fe(OH)3,紫红色金属I为Cu,据此解答.
解答 解:金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;B是地壳中含量最多的金属,氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.金属C与盐酸反应得到F,F与氯气反应得到G,G与氢氧化钠与得到红褐色沉淀H,则C为Fe,F为FeCl2,G为FeCl3,H为Fe(OH)3,紫红色金属I为Cu.
(1)由上述分析可知,C为Fe、H为Fe(OH)3,故答案为:Fe;Fe(OH)3;
(2)气体甲在气体乙中燃烧的化学方程式:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,该反应的现象有:安静燃烧,苍白色火焰,瓶口有白雾,
故答案为:H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl;安静燃烧,苍白色火焰,瓶口有白雾;
(3)反应③的化学方程式:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,向反应③所得溶液中通入过量的CO2,反应的离子方程式:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(4)反应⑤的离子方程式:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(5)物质D中阳离子为钠离子,具有钠离子的方法名称是:焰色反应,
故答案为:焰色反应.
点评 本题考查无机物的推断,特殊的颜色与特殊反应是推断的突破口,熟练掌握元素化合物的性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H+、OH-、Na+、Cl- | B. | K+、NO3-、Cu2+、Cl- | ||
| C. | Ba2+、SO42-、Na+、OH- | D. | Fe3+、OH-、NH4+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症.
由C、N、O、Na、Fe五种元素组成的配合物Na2[Fe(CN)5(NO)]可用于治疗高血压急症. ,未成对电子数为5.
,未成对电子数为5.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
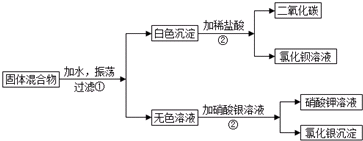
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将BaSO4放入水中不能导电,所以硫酸钡不是电解质 | |
| B. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| C. | 氯化氢溶于水能导电,但液态氯化氢不能导电 | |
| D. | 固态的NaCl不导电,熔融态NaCl可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、CO2、SiO2中的S、C、Si均为sp3杂化 | |
| B. | SO32-、CO32-、SiO32-均为平面三角形 | |
| C. | H3O+、NH4+、[Cu(NH3)4]2+均含有配位键 | |
| D. | 石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
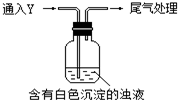 某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:
某校探究性活动小组的同学对Na2SO3与AgNO3在不同的pH条件下的反应原理进行实验探究,请你一起参与探究活动并回答有关问题:| 实验 | pH | 实 验 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com