
我国是个农业大国,农业是立国之本,“农村、农业、农民”是党中央新时期农村工作的重心,化肥与农药的发展起着巨大的推动作用,请回答下列问题:
(1)农作物生长过程中不可缺少的微量元素有Fe、Mn、B、Cu、Mo等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质的形成和新陈代谢不可缺少的。常用铜肥是胆矾,在盐碱地(土壤pH>7)施用胆矾时宜将溶液________(填“喷在叶片上”或“随水灌入土壤中”),主要理由是_______________________________________________________
________________________________________________________________________。
(2)农药波尔多液是一种常用的杀菌剂,常用配方为胆矾、生石灰、水,按质量比1∶0.56∶100混合,分析其防治病虫害的原因________________________________________。
(3)拟除虫菊酯是一种高效、低毒,对昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:

其分子式为________________________,则下列对该化合物的叙述正确的是________(填字母代号)。
A.该化合物属于芳香烃
B.该化合物属于卤代烃
C.该化合物在碱性条件下失去药效
D.该化合物在一定条件下可发生加成反应
(1)喷在叶片上 Cu2+在碱性条件下生成不溶物,农作物根部不易吸收
(2)Cu2+在碱性条件下使菌体蛋白质变性 (3)C23H21NO3Br2 CD
【解析】
试题分析:(1)胆矾的水溶液显酸性,在碱性土壤中,由于Cu2+与碱性物质结合生成不易被农作物吸收的不溶物,所以宜在农作物叶面喷施。
(2)Cu2+为重金属离子,其药效体现在能使细菌的蛋白质变性,而达到杀菌效果。当胆矾、生石灰、H2O的质量比为1∶0.56∶100时,其中n(Cu2+)∶n(Ca2+)=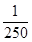 ∶
∶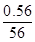 =2∶5,当波尔多液的有效成分为CuSO4·xCu(OH)2·yCa(OH)2时,且x=1,由于CuSO4与Ca(OH)2反应生成Cu(OH)2,可结合:
=2∶5,当波尔多液的有效成分为CuSO4·xCu(OH)2·yCa(OH)2时,且x=1,由于CuSO4与Ca(OH)2反应生成Cu(OH)2,可结合:
CuSO4+Ca(OH)2===Cu(OH)2↓+CaSO4
反应前 2 5 0 0
反应后 1 1
所以CuSO4·Cu(OH)2·yCa(OH)2中y=5-1=4。
(3)拟除虫菊酯是一种酯类化合物,所以该化合物不属于烃类,该化合物具有酯的性质,在碱性条件下水解而失效,该化合物中含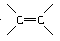 ,苯环及—C≡N能发生加成反应,其分子式为C23H21NO3Br2。
,苯环及—C≡N能发生加成反应,其分子式为C23H21NO3Br2。
考点:考查胆矾在农业生产中的应用、波尔多液配制、性能和有机物分子式判断、性质
点评:该题是中等难度的试题,试题综合性强,难易适中,注重考查学生灵活运用基础知识解决实际问题的能力。关于有机物的结构和性质解题的关键是准确判断出分子中含有的官能团,然后在根据相应官能团的结构和性质,灵活分析、判断即可。该题有利于培养学生严谨的逻辑思维能力和发散思维能力。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:阅读理解
| 3 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年吉林省吉林一中高一11月月考化学试卷(带解析) 题型:计算题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。某种矿石中铁元素以氧化物FemOn的形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6g。剩下滤液用浓度为2mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0mL。
提示:2Fe3++Cu === 2Fe2++Cu2+ 8H++MnO4-+5Fe2+ === Mn2++5Fe3++4H2O
(1)计算该铁矿石中铁元素的质量分数。
(2)计算氧化物FemOn的化学式(m、n为正整数)。
查看答案和解析>>
科目:高中化学 来源:2011届江苏省南通市高三第一次调研测试化学试卷 题型:计算题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2 (g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H= ▲ 。
⑵800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20mol·L-1、c(CO2)=0.05mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20mol·L-1、c(CO2)=0.05mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜
粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式(m、n为正整数)
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高一11月月考化学试卷(解析版) 题型:计算题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。某种矿石中铁元素以氧化物FemOn的形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6g。剩下滤液用浓度为2mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0mL。
提示:2Fe3++Cu === 2Fe2++Cu2+ 8H++MnO4-+5Fe2+ === Mn2++5Fe3++4H2O
(1)计算该铁矿石中铁元素的质量分数。
(2)计算氧化物FemOn的化学式(m、n为正整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com