
【题目】(1)如图是一个化学过程的示意图。
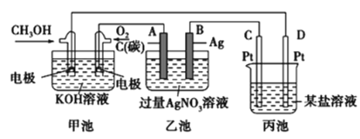
①乙池中总反应的离子方程式____________。
②电解一段时间后,向乙池的溶液中加入________________可恢复为原溶液。
③当乙池中B(Ag)极的质量增加5.40g,此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是________。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
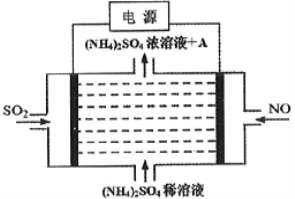
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出负极的电极反应式:___________。
②图中X溶液是________。
③利用图中设计的原电池为电源可将雾霾中的NO、SO2电解分别转化为NH4+和SO42-,如图所示,则物质A的化学式为_____________,阴极的电极反应式为______________。
【答案】4Ag++2H2O![]() 4Ag+O2↑+4H+ Ag2O BD Cu-2e-=Cu2+ FeCl3溶液 H2SO4 NO+5e-+6H+=NH4++H2O
4Ag+O2↑+4H+ Ag2O BD Cu-2e-=Cu2+ FeCl3溶液 H2SO4 NO+5e-+6H+=NH4++H2O
【解析】
(1)甲池为甲醇燃料电池,通入甲醇的一极为负极,通入氧气的为正极;乙池为电解池,A与燃料电池的正极相连,为阳极,B为阴极;丙为电解池,D与燃料电池的负极相连,为阴极,C为阳极;
(2)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,Cu元素化合价升高,为负极,Fe元素化合价降低,FeCl3在正极反应,X溶液为FeCl3溶液。
(1)①乙池为电解池,A为阳极,水失电子生成O2和H+,B为阴极,Ag+得电子生成Ag,总反应为:4Ag++2H2O![]() 4Ag+O2↑+4H+,故答案为:4Ag++2H2O
4Ag+O2↑+4H+,故答案为:4Ag++2H2O![]() 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
②从总反应来看,电解过程Ag原子和O原子按2:1以Ag和O2的形式析出了,所以,加一定量的Ag2O能恢复为原溶液,故答案为:Ag2O;
③乙池中B(Ag)极的电极反应式为:Ag++e-=Ag,当Ag极增加5.4g,即n(Ag)=![]() =0.05mol时,由Ag++e-=Ag可知,通过电路中的电子的物质的量n(e-)=0.05mol。丙池为电解池,阴极表面析出金属,该金属的阳离子的放电顺序要在水电离的H+前面,否则不会析出金属。要生成1.6g固体,则生成1.6g固体转移的电子的物质的量必须小于等于0.05mol(生成1.6g固体后,若金属离子已反应完,H2O电离的H+继续得电子即可)。
=0.05mol时,由Ag++e-=Ag可知,通过电路中的电子的物质的量n(e-)=0.05mol。丙池为电解池,阴极表面析出金属,该金属的阳离子的放电顺序要在水电离的H+前面,否则不会析出金属。要生成1.6g固体,则生成1.6g固体转移的电子的物质的量必须小于等于0.05mol(生成1.6g固体后,若金属离子已反应完,H2O电离的H+继续得电子即可)。
A.Mg2+的放电顺序在H+之后,不会析出金属Mg,A错误;
B.Cu2+的放电顺序在H+之前,Cu2++2e-=Cu,则析出Cu的质量=1.6g,则通过电路的电子的物质的量n(e-)=0.05mol,符合题意,B正确;
C.Na+的放电顺序在H+之后,不会析出金属Na,C错误;
D.Ag+的放电顺序在H+之前,Ag++e-=Ag,析出1.6g固体(Ag)时,即n(Ag)=![]() =
=![]() ,则通过电路的电子的物质的量n(e-)=n(Ag)=
,则通过电路的电子的物质的量n(e-)=n(Ag)=![]() ≈0.0148mol<0.05mol,符合题意,D正确;
≈0.0148mol<0.05mol,符合题意,D正确;
故答案为:BD;
(2)①Cu失电子,化合价升高,作负极,电极反应式为:Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
②Cu作负极,则C作正极,FeCl3在正极得电子生成FeCl2,则X溶液为FeCl3溶液,故答案为:FeCl3溶液;
③NO得电子,转化为NH4+,则电解池右边电极为阴极,电极反应式为:NO+5e-+6H+=NH4++H2O,SO2失电子,转化为SO42-,左边电极为阳极,电极反应式为:SO2-2e-+2H2O=SO42-+4H+,总反应为:![]() ,所以,物质A为H2SO4,故答案为:H2SO4;NO+5e-+6H+=NH4++H2
,所以,物质A为H2SO4,故答案为:H2SO4;NO+5e-+6H+=NH4++H2


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】探究物质的结构有助于对物质的性质进行研究。
(1)① 下列物质中含有羧基的是__________________(填字母)。
a.![]() b.
b.![]() c.
c.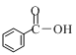
② 下列物质分子中所有原子处于同一平面的是__________________(填字母)。
a.苯 b.丙烯 c.甲醇
(2)乙烯使溴水或溴的四氯化碳溶液褪色的化学方程式_____________________,属于________反应,
(3)灼热的铜丝多次反复地插入乙醇中的现象是:___________________________,属于_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性好的树脂,下面是一种醇酸树脂的合成线路:
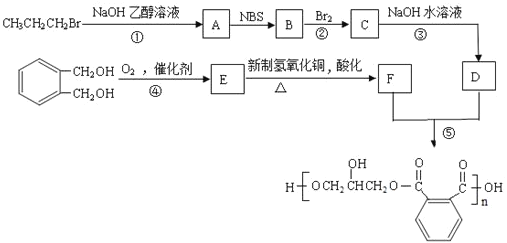
已知:RCH2CH=CH2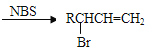
(1)写出B的结构简式是___。
(2)反应①~⑤中属于取代反应的是___(填序号)。
(3)写出由C→D的化学方程式___。
(4)写出由E与新制氢氧化铜反应的化学方程式___,现象___。
(5)下列说法正确的是___(填字母)。
a.1molE与足量的银氨溶液反应能生成2molAg
b.1molF能与足量的NaHCO3反应产生1molCO2
c.丁烷、1﹣丙醇和D中沸点最高的为D
(6)写出符合下列条件的与 互为同分异构体的结构简式___。
互为同分异构体的结构简式___。
a.能与浓溴水反应生成白色沉淀
b.苯环上一氯代物有两种
c.能发生消去反应
(7)反应⑤的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
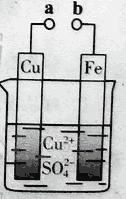
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 A、B、C、D、E 的原子序数依次增大。常温下,A、C 组成的化合物是常见液体,B 原子最外层电子数等于次外层电子数的 2 倍,D 与 C 同主族。回答下列问题:
(1) A 的单质的电子式为 ______ ;B 在元素周期表中的位置为第____周期第_____ 族。
(2) B、C 中,原子半径大的是______(填元素符号);D、E 的简单氢化物中,稳定性较强的是______(填化学式)。
(3) A、C 组成的原子个数比为 1:1 的化合物常用于制备 C 的单质,反应的化学方程式为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.已知冰的熔化热为6.0kJ·mol-1,冰中氢键键能为20kJ·mol-1。假设每摩尔水中有2mol氢键,且熔化热完全用于打破冰的氢键,则最多只能破坏冰中15%的氢键
B.实验检测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ·mol-1、-3747kJ·mol-1和-3265kJ·mol-1,可以证明在苯分子中不存在独立的碳碳双键
C.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Ka=![]() 。若加入少量CH3COONa固体,则电离平衡CH3COOHCH3COO-+H+向左移动,α减小,Ka变小
。若加入少量CH3COONa固体,则电离平衡CH3COOHCH3COO-+H+向左移动,α减小,Ka变小
D.“水”电池是一种能利用淡水与海水之间含盐量差别进行发电的装置,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。则每生成1molNa2Mn5O10转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
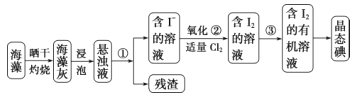
(1) 指出从海藻中提取 I2 的实验操作名称:① _______ ,③_______;写出②的离子方程式:______ 。
(2) 提取碘的过程中,可供选择的有机溶剂是________。
A 酒精 B 四氯化碳 C 醋酸 D 甘油
(3) 为使海藻中 I-转化为碘的有机溶液,实验室里有坩埚、烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,还缺少的仪器是 _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活、环境等密切相关,下列说法正确的是![]()
A.用加酶洗衣粉洗衣服时水的温度越高越好
B.“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
C.小苏打是制作馒头的膨松剂,苏打是治疗胃酸过多的抗酸剂
D.乙醇、过氧化氢、次氯酸钠等消毒液的消毒原理都是利用其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是

A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.产生气泡的速度甲比乙慢
D.两烧杯中溶液的 H+的浓度均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com