
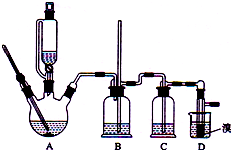
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
分析 装置A是乙醇在浓硫酸的存在下在170℃脱水生成乙烯,浓硫酸的强氧化性、脱水性导致市场的乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质,通过装置B中长导管内液面上升或下降调节装置内压强,B为安全瓶,可以防止倒吸,根据E中内外液面高低变化,可以判断是否发生堵塞,二氧化碳、二氧化硫能和氢氧化钠溶液反应,装置C是利用氢氧化钠溶液吸收杂质气体,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,装置D冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品.
(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大;
(5)常温下下Br2和氢氧化钠发生反应,可以除去混有的溴;
(6)溴易挥发,冷却防止溴大量挥发;1,2-二溴乙烷的凝固点较低(9℃).
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成,选择d;
故答案为:d;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应而被吸收,故选c,
故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,
故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,有机层在下层,
故答案为:下;
(5)a.溴更易溶液1,2-二溴乙烷,用水无法除去溴,故a错误;
b.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,故b正确;
c.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故c错误;
d.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故d错误,
故答案为:b;
(6)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,
故答案为:冷却可避免溴的大量挥发.
点评 本题考查有机物合成实验,为高频考点,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )
硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )| A. | 该反应在高温时比低温更易自发进行 | |
| B. | 曲线I上A、C两点反应速率的关系是:vA<vC | |
| C. | T0时该反应的平衡常数为160 | |
| D. | 已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则II是Fe2O3作催化剂的曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:
亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90% | B. | 80% | C. | 45% | D. | 10% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g水含有的原子数为NA | |
| B. | 4g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1molO2的质量等于1mol氧原子的质量 | |
| D. | 24gO2和24gO3所含的原子数目相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com