
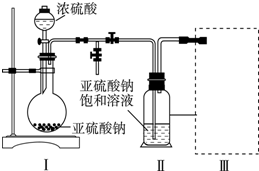
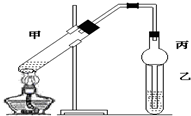
���� ��1����װ�â��з����ķ�Ӧ��֪��װ�â��в���������ΪSO2���������������ᷴӦ���������ơ�����������ˮ��
��2��װ�â��л���������ľ��壬���������Һ̬��Ӧ��ȡ���˲�����
��3��װ�â����ڴ���β��������Ϊ��Ӧ�Ķ�������Ӧ��ֹ�������Ҳ��ܴ�����ȫ�ܱջ����У�
��4��NaHSO3��Һ��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ���Һ�����ԣ��ʼ�����Һ�����Լ��ɣ�
��5��Na2S2O5�����ڿ������ױ�����ΪNa2SO4�������ᡢ�Ȼ�����Һ������Ʒ���Ƿ�����������ɣ�
��6���������ĵ���������SO2+I2+2H2O�TH2SO4+2HI��������������������������Ũ�ȣ�
�����в���HI�����������������ĵ����ƫС���ʲⶨ�����������ƫС��
��� �⣺��1����װ�â��з����ķ�Ӧ��֪��װ�â��в���������ΪSO2���������������ᷴӦ���������ơ�����������ˮ����Ӧ����ʽΪ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O��
�ʴ�Ϊ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O��
��2��װ�â��л���������ľ��壬���������Һ̬��Ӧ��ȡ���˽��з��룬
�ʴ�Ϊ�����ˣ�
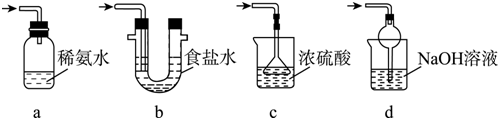
��3��a��װ��Ӧ���������백ˮ�п������ն�������Ϊ�ܱջ�����װ����ѹǿ�����ײ�����ȫ�¹ʣ��ʴ���
b����װ�����ն������������ϲ��Ϊ�ܱջ�����װ����ѹǿ�����ײ�����ȫ�¹ʣ��ʴ���
c����װ�ò������ն�������������ʵ��ʵ��Ŀ�ģ��ʴ���
d����װ���������������������Ӧ���������գ��ҷ�ֹ����������ȷ��
�ʴ�Ϊ��d��
��4��NaHSO3��Һ��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ���Һ�����ԣ��ⶨ��Һ��pH������ȷ����Һ����ԣ�������Һ����ʹʪ����ɫʯ����ֽ��죬�������òⶨ��ҺpHֵ��ʪ�����ɫʯ����Һ���飬������Ba��OH��2��Һ��HCl��Һ��Ʒ����Һ������˵����Һ�����ԣ���ѡae��
�ʴ�Ϊ��ae��
��5��Na2S2O5��SԪ�صĻ��ϼ�Ϊ+4�ۣ���˻ᱻ����ΪΪ+6�ۣ��������ڿ������ױ�����ΪNa2SO4�������ᡢ�Ȼ�����Һ������Ʒ���Ƿ�����������ɣ�ʵ�鷽��Ϊ��ȡ����Na2S2O5�������Թ��У���������ˮ�ܽ⣬�μ����ᣬ���ٵμ��Ȼ�����Һ���а�ɫ�������ɣ�
�ʴ�Ϊ��ȡ����Na2S2O5�������Թ��У���������ˮ�ܽ⣬�μ����ᣬ���ٵμ��Ȼ�����Һ���а�ɫ�������ɣ�
��6������100mL���Ѿ��ж������������Ϊmg����
SO2+2H2O+I2�TH2SO4+2HI
64g 1mol
mg 0.025L��0.01mol/L
���ԣ�64g��mg=1mol��0.025L��0.01mol/L��
���m=0.016
�ʸô�ʵ������Ʒ�п��������IJ�������������SO2���㣩Ϊ$\frac{0.016g}{0.1L}$=0.16 g/L
�ʴ�Ϊ��0.16��
�����в���HI�����������������ĵ����ƫС���ʲⶨ�����������ƫС����ⶨ���ƫ�ͣ�
�ʴ�Ϊ��ƫ�ͣ�
���� ���⿼�����ʵ��Ʊ�ʵ�顢ʵ�鷽����ơ����ʺ����IJⶨ��������ԭ��Ӧ�ζ��ȣ��Ѷ��еȣ���ȷʵ��ԭ���ǽⱾ��ؼ����������ʵ����ʷ������ע��Ԫ�ػ�����֪ʶ�Ļ��ۺ�������ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ʱ���ܷ����Ĺ��̶��Ƿ��Է����� | |
| B�� | ��ϵ��������Խ�ߣ������Ҷ�Խ�ߣ���ֵ��Խ�� | |
| C�� | �����Է����еĻ�ѧ��Ӧ���Ƿ��ȷ�Ӧ | |
| D�� | ͬһ���ʵĹ̡�Һ��������״̬����ֵ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ڢۢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʢŨ����ķ�Һ©�����ó���©������ | |
| B�� | ���ڼ���ƿ�ڷ�һ��ʪ��ĵ��۵⻯����ֽ���۲������Ƿ��ռ��� | |
| C�� | �ñ���ʳ��ˮ����β�� | |
| D�� | Ϊ�˱���ѧ���۲��������Ʊ�ʵ�飬���ڽ�̨��ֱ�����������Ʊ�ʵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��һ�� | �ڶ��� | ������ | |
| �����mL�� | 16.10mL | 16.60mL | 15.90mL |
�鿴�𰸺ͽ���>>
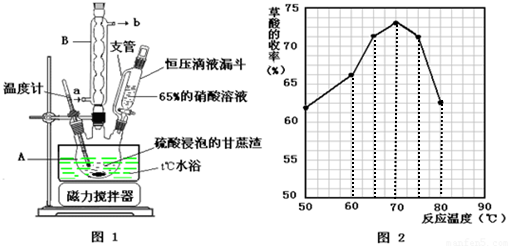
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 +CaCl2+H2O���÷�Ӧ��ԭ��������25.4%��
+CaCl2+H2O���÷�Ӧ��ԭ��������25.4%�� ��
�� �����Ҷ������ã�������һϵ�л����
�����Ҷ������ã�������һϵ�л����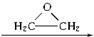 HO-CH2-CH2-O-CH2-CH2-OH
HO-CH2-CH2-O-CH2-CH2-OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ���� | C�� | ������̼ | D�� | ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com