
| A. | NF3分子呈三角锥形 | |
| B. | NF3分子是极性分子 | |
| C. | NF3与NH3晶体类型相同 | |
| D. | 上述反应的反应物和生成物均属于共价分子 |
分析 A.根据NH3分子构型判断NF3分子构型;
B.分子结构不对称,正负电荷中心不重叠,则为极性分子,反之为非极性分子;
C.NF3与NH3都为分子晶体;
D.NH4F含铵根离子、氟离子,是离子化合物.
解答 解:A.氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,所以氮原子杂化方式是sp3,因为含有一个孤电子对,所以是三角锥型结构,NF3分子构型与NH3相似,所以NF3分子构型也是三角锥型的,故A正确;
B.NF3分子构型与NH3相似,NH3分子构型是三角锥型的,所以NF3分子构型也是三角锥型的,三角锥形分子的结构不对称,正负电荷中心不重叠,为极性分子,故B正确;
C.NF3存在N-F键,NH3存在N-H键,都为分子晶体,NF3与NH3晶体类型相同,故C正确;
D.氨气、氟气以及NF3为分子晶体,NH4F中存在的化学键是离子键、共价键,NH4F是离子化合物,故D错误;
故选D.
点评 本题考查物质的结构、化学键、物质的分类等知识,类推方法的应用是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
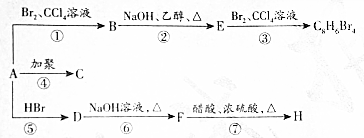
 ,D
,D ,E
,E .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O(消去反应).
+2NaBr+2H2O(消去反应). +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaBr(取代反应).
+NaBr(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成的正盐化学式为BmAn | |
| B. | 该盐中存在着一定水解的离子,该离子水解方程式为:Bm++mH2O?B(OH)m+mH+ | |
| C. | 生成的盐为强酸弱碱盐 | |
| D. | HnA为弱酸,其第一步电离方程式为:HmA?Hm-1A-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH3CHBrCH2Br | D. | BrCH2CH2CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中失去电子的电极为阳极 | |
| B. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| C. | 电解时电解池的阳极一定是阴离子放电 | |
| D. | 原电池的负极、电解池的阳极都发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质与水反应的通式为X2+H2O?HX+HXO | |
| B. | HX都极易溶于水,它们的热稳定性随核电荷数增大而增强 | |
| C. | 卤素单质的颜色随相对分子质量增大的顺序而加深 | |
| D. | X-离子的还原性依次为:F-<Cl-<Br-<I-,因此相对分子质量小的卤素单质可将相对分子质量大的卤素从它的盐溶液里置换出来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com