
| A. | 常温下将pH=3的醋酸稀释到原体积的10倍后,溶液的pH=4 | |
| B. | c( H+)>c(OH-)的溶液一定显酸性 | |
| C. | 常温下,pH=6 的溶液一定是酸的溶液 | |
| D. | 将纯水加热,其KW增大而pH不变 |
分析 A.醋酸是弱电解质,加水稀释过程中会继续电离;
B.任何电解质水溶液中如果存在c( H+)>c(OH-),则溶液一定显酸性;
C.常温下,pH=6的溶液可能是强酸弱碱盐溶液;
D.水的电离是吸热反应,升高温度促进水电离.
解答 解:A.醋酸是弱电解质,加水稀释过程中会继续电离,所以常温下将pH=3的醋酸稀释到原体积的10倍后,溶液的pH<4,故A错误;
B.任何电解质水溶液中如果存在c( H+)>c(OH-),则溶液一定显酸性,如果c( H+)=c(OH-),则溶液呈中性,如果c( H+)<c(OH-),则溶液呈碱性,故B正确;
C.常温下,pH=6的溶液可能是强酸弱碱盐溶液,强酸弱碱盐中弱碱离子水解导致溶液呈酸性,故C错误;
D.水的电离是吸热反应,升高温度促进水电离,溶液中氢离子浓度增大,所以KW增大而pH变小,故D错误;
故选B.
点评 本题考查探究溶液酸碱性及弱电解质的电离,注意溶液酸碱性要根据c( H+)、c(OH-)的相对大小判断,不能根据溶液pH大小判断,易错选项是D.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙酸钠 | B. | 油酸甘油酯 | C. | 乙酸乙酯 | D. | 甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O
+NaCl+H2O +(2n-1)H2O
+(2n-1)H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验标号 | 初始浓度/mol•L-1 | 生成N2的初速率/mol•L-1•s-1 | |
| c(NO) | c(H2) | ||
| 1 | 6.00×10-3 | 1.00×10-3 | 3.19×10-3 |
| 2 | 6.00×10-3 | 2.00×10-3 | 6.38×10-3 |
| 3 | 6.00×10-3 | 3.00×10-3 | 9.57×10-3 |
| 4 | 1.00×10-3 | 6.00×10-3 | 0.48×10-3 |
| 5 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
| 6 | 3.00×10-3 | 6.00×10-3 | 4.32×10-3 |
| A. | 增大c(H2),生成N2的初速率增大 | B. | 减小c(NO),生成N2的初速率减小 | ||
| C. | 生成N2的初速率与c(H2)成正比 | D. | 生成N2的初速率与c(NO)成正比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
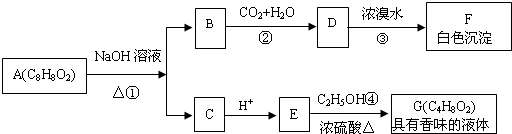
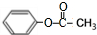 .
.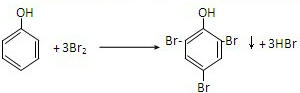 ,该反应的反应类型是取代反应.
,该反应的反应类型是取代反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.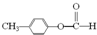 .
.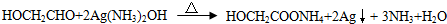 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀.然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体.请回答:
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀.然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸铜溶液反应的离子方程式为Ba2++SO42-═BaSO4↓ | |
| B. | 氢气的燃烧热为285.8KJ/mol,所以表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H≈-571.6KJ/mol | |
| C. | 原子序数为1和8的两种元素形成的18电子的化合物的电子式为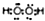 | |
| D. | 铜锌原电池的正极反应式一定为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将乙酸乙酯与NaOH溶液共热一段时间后,可看到分层消失 | |
| B. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 | |
| C. | 将铜丝在酒精灯外焰上加热后,再将铜丝转移至内焰,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com