
【题目】(6分)在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡(X、Y、Z均为气态)。

(1)该反应的化学方程式是 。
(2)反应起始至t时刻,Y的平均反应速率是 。
(3)关于该反应的说法正确的是 。
A.到达t时刻该反应已停止 |
B.在t时刻之前X的消耗速率大于它的生成速率 |
C.在t时刻正反应速率等于逆反应速率 |
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等 |
【答案】(1)(2分)2X![]() 3Y+Z(写“ = ”扣1分)
3Y+Z(写“ = ”扣1分)
(2)(2分)0.6/t mol·(L·min)-1(不写单位或写错扣1分)
(3)(2分)BC(对1个得1分,多答或错答0分)
【解析】(1)根据图像可知X的物质的量减少,Y、Z的物质的量增加,所以X是反应物,Y、Z是生成物。到达平衡时X、Y、Z的变化量分别为2.4mol-1.6mol=0.8mol、1.2mol、0.4mol,所以变化量之比是2︰3︰1,因此该反应的化学方程式是2X![]() 3Y+Z。
3Y+Z。
(2在t’时刻内Y的浓度变化量是![]() ,所以Y的平均反应速率是0.6/tmol·(L·min)-1。
,所以Y的平均反应速率是0.6/tmol·(L·min)-1。
(3)可逆反应达到平衡后,正逆反应速率相等,但不等于0,A不正确,C正确。在t时刻之前反应还没有达到平衡状态,此时正反应速率大于逆反应速率,所以B正确。可逆反应之所以会达到平衡状态,是由于正逆反应速率相等,导致在相同时间内消耗的和生成的量一样多,从而使各种物质的的含量不再发生变化,D不正确。


科目:高中化学 来源: 题型:
【题目】(8分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)

①该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响: 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生的化学反应方程式 _______________ ______。
②实验结果说明催化剂作用的大小与________ _________ 有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在科学史上每一次重大的发现都极大地推进了科学的发展。我国宁波藉科学家屠呦呦获得诺贝尔生理学或医学奖,她成为首获科学类诺贝尔奖的中国本土科学家。她获奖的原因是发现了
A. 青蒿素 B. 合成氨的生产工艺
C. 提示了燃烧的本质 D. 维生素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
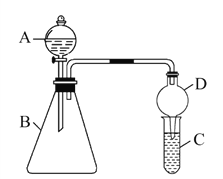
利用如图装置验证同主族元素非金属性的变化规律。
(1)干燥管D的作用为____。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液____的现象即可证明,写出C中反应的离子方程式_______________。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中溶液____的现象,即可证明。但有同学认为该实验存在不足,请简要说明___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中相邻元素之间原子序数的关系正确的是( )
A.相邻主族的元素的原子序数之差一定都是1
B.主族中相邻元素的原子序数之差只有1、11、25
C.相邻周期元素的原子序数之差一定都是8
D.相邻周期元素的原子序数之差可能有2、8、18、32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=13的溶液中,能大量共存的离子组是:
A. Na+、NH4+、Clˉ、SO42ˉ B. K+、Na+、AlO2ˉ、Clˉ
C. Mg2+、K+、NO3ˉ、Clˉ D. K+、Na+、Al3+、SO42ˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量: 。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量: 。
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量: 。
⑷已知下列反应的反应热为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ/mol
试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com