
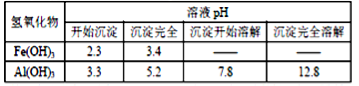
【题目】已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的量如下表。
向FeCl3、Al2(SO4)3的混合溶液中逐有加入Ba(OH)2溶液,形成沉淀的情况如下图所示.以下推断错误的是
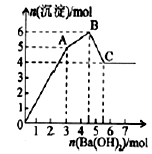
A.AB段可能发生的反应:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C点对应的沉淀:Fe(OH)3和BaSO4
C.OA段可能发生的反应:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中:c(Cl-)=c(SO42-)
【答案】A
【解析】
试题分析:含有硫酸铝和氯化铁的混合溶液与氢氧化钡溶液反应的实质是铁离子或铝离子与氢氧根反应,钡离子与硫酸根离子反应。假设1mol硫酸铝中硫酸根离子完全被沉淀所需氢氧化钡的物质的量为3mol,提供6mol氢氧根离子,图表分析铁离子先沉淀,由图像分析,OA段为加入3mol氢氧化钡,发生的反应为硫酸根离子和钡离子反应生成硫酸钡,得到3mol硫酸钡沉淀,C点为氢氧化铝溶解后的沉淀物质的量为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol,分析判断OA段沉淀3mol钡离子,1mol铁离子和1mol铝离子,AB段为沉淀为1mol铝离子,BC段为溶解氢氧化铝消耗氢氧化钡1mol。A.AB段可能发生的反应是铝离子和氢氧根离子反应生成氢氧化铝,A项错误,B根据分析可知,C点沉淀为硫酸钡和氢氧化铁,B项正确,C.OA段可能发生的反应有沉淀钡离子,铁离子、铝离子,反应为3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓,C项正确;D.图像分析,氯化铁和硫酸铝的混合溶液中含有氯化铁1mol,含硫酸铝1mol,则氯离子浓度和硫酸根离子浓度相等,D项正确;答案选A。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】下列事实中,能证实一元酸HR是弱电解质的是( )
A.HR溶液和KCl溶液不发生反应
B.能与水以任意比例互溶
C.0.1 mol·L-1 的HR溶液中c(R- ) =0.01 mol·L-1
D.HR属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH―=NH3↑+H2O
B.用惰性电极电解饱和氯化钠溶液:2Cl―+2H+![]() H2↑+Cl2↑
H2↑+Cl2↑
C.向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I―=2Fe2++I2
D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32―+6H++2MnO4―=5SO42―+2Mn2++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
A.常温下,48gO3含有的氧原子数3NA
B.标准状况下,33.6LCO中含有的原子数是3NA
C.0.5mol·L-1CaCl3溶液中含Cl-数目为NA
D.17gNH3所含的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )
A.通入标准状况下的HCl气体11.2V L
B.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C.将溶液加热浓缩到0.5V L
D.加入V L 1.5 mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态芳香烃的相对分子质量为106,其分子结构中含有一个苯环,具有这种结构的同分异构体共有( )
A. 2种 B. 5种 C. 4种 D. 3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com