
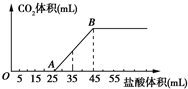
| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO${\;}_{3}^{2-}$+H+═HCO${\;}_{3}^{-}$ | |
| B. | 当加入35 mL盐酸时,产生CO2的体积为224 mL | |
| C. | A点溶液中的溶质为NaCl、NaHCO3 | |
| D. | 混合物中NaOH的质量0.60 g |
分析 A、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3-;
B、AB段发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,根据方程式来求解;
C、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3-,所以A点的溶质为NaC1、NaHCO3;
D、根据AB段求出二氧化碳的物质的量,然后根据碳守恒求出碳酸钠的质量,最后根据总质量求氢氧化钠的质量.
解答 解:A、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3-,故A正确;
B、AB段发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,根据方程式n(CO2)=(35-25)×10-3L×1mol/L=0.01mol,所以二氧化碳的体积为:0.01mol×22.4L/mol=224mL,故B正确;
C、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3-,所以A点的溶质为NaC1、NaHCO3,故C正确;
D、由反应HCO3-+H+=H2O+CO2↑,n(CO2)=n(Na2CO3)=(45-25)×10-3×1=0.02mol,所以氢氧化钠的质量为2.32g-0.02×106g=0.2g,故D错误;
故选D.
点评 本题考查混合物计算,理解判断各阶段发生的反应是关键,侧重学生分析判断和计算能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
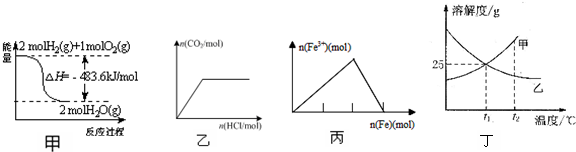
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 | |
| C. | 丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+浓度的变化曲线 | |
| D. | 丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据上述步骤Ⅱ可以得出m(Fe2O3):m(Cu)=1:1 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融状态下的NaHSO4电离:NaHSO4═Na++H++SO${\;}_{4}^{2-}$ | |
| B. | Fe(OH)3的电离:Fe(OH)3?Fe3++3OH- | |
| C. | H2CO3的电离:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 水溶液中的NaHSO4电离:NaHSO4═Na++HSO${\;}_{4}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| 指示剂 | 变色范围(pH) | 颜色 | |
| 酸 | 碱 | ||
| 甲基橙 | 3.1~4.4 | 红 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol锌粒与足量盐酸反应产生11.2L H2 | |
| B. | 标准状况下,11.2L H2O所含分子数为0.5NA | |
| C. | 0.5mol•L-1的MgCl2溶液中含有Cl-个数为NA | |
| D. | 25℃、101Pa时,16g O2和O3混合气体中含有的原子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com