
| A. | BOH溶于水,其电离方程式是BOH═B++OH- | |
| B. | 若将一定量的上述溶液混合后pH=7,则c(A- )=c(B+) | |
| C. | 在0.1 mol/L BA溶液中,c(B+)>c(A- )>c(OH- )>c(H+) | |
| D. | 若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH=9 |
分析 0.1mol/LHA溶液的PH=1,说明HA完全电离,为强电解质,0.1mol/L的BOH溶液的pH=11,说明碱不完全电离,为弱电解质,
A.BOH中氢氧根离子浓度小于碱浓度,所以BOH是弱碱,弱碱不完全电离;
B.混合溶液pH=7,则溶液中c(OH-)=c(H+),再结合电荷守恒判断;
C.HA为强酸,BOH是弱碱,BA是强酸弱碱盐,其溶液呈酸性,再结合电荷守恒分析;
D.弱电解质溶液中都存在电离平衡,加水稀释促进弱电解质电离.
解答 解:A.BOH是弱碱,溶于水只有部分电离,溶液中存在电离平衡,所以其电离方程式是BOH?B++OH-,故A错误;
B.混合溶液pH=7,则溶液中c(OH-)=c(H+),溶液中存在电荷守恒c(B+)+c(H+)=c(A-)+c(OH-),所以得c(A-)=c(B+),故B正确;
C.BA是强酸弱碱盐,其溶液呈酸性,c(H+)>c(OH-),结合电荷守恒c(B+)+c(H+)=c(A-)+c(OH-)知,0.1 mol•L-1 BA溶液中,c(A-)>c(B+)>c(H+)>c(OH-),故C错误;
D.BOH是弱碱,溶液中存在电离平衡,将0.1mol•L-1 BOH溶液稀释至0.001mol•L-1,稀释过程中促进弱碱电离,所以溶液的pH>9,故D错误;
故选B.
点评 本题考查酸碱混合离子的浓度关系,明确信息中pH及离子的关系来判断酸碱的强弱是解答本题的关键,并熟悉电离、盐类水解等知识来解答,题目难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | 元素Z位于元素周期表的第3周期Ⅵ族 | |
| C. | Y形成的单质能在二氧化碳中燃烧 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨转化为金刚石不是化学变化 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨具有的总能量比1mol金刚石的低 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
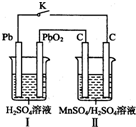 锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.
锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为Mn2+-2e-+2H20=MnO2+4H+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
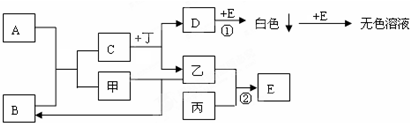
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强不再变化 | |
| B. | 混合气体的总质量不再变化 | |
| C. | 每生成2mol SO3的同时,消耗1mol SO2 | |
| D. | 每生成2mol SO2的同时,消耗2mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
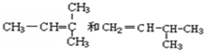
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
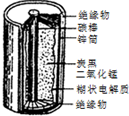 某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:
某学校设计了一节实验活动课,让学生从废旧的锌锰酸性干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质,整个实验过程如下,请回答有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com