
下列化学用语或模型表示正确的是( )
A.Cl-离子的结构示意图: B.CCl4分子的球棍模型:
B.CCl4分子的球棍模型:
C.乙烯的结构简式 CH2CH2 D.H2O2的结构式:H—O—O—H
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(16分)活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用。但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义。下图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程:
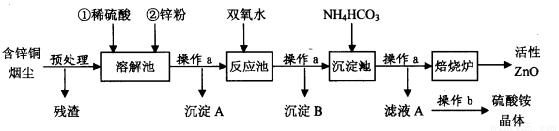
含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3。
(1)操作a名称是____ ,在实验室中,该过程用到的主要玻璃仪器有 。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;② :③调节溶液的pH(控制其在5,0-5.4之间)。
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是 ;
(4)右表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol-l计算)。反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方
程式: 。
| 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
2n2+ | 5.9 | 8.9 |
(5)操作b的名称是________ ;
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3·bZn(OH)2·cH2O(a、b、c均为整数)。某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,则该沉淀的组成为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:填空题
(14分)工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
①N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol ②2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
③C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO的原理如图1,A为电源的 极,阴极反应式为 。
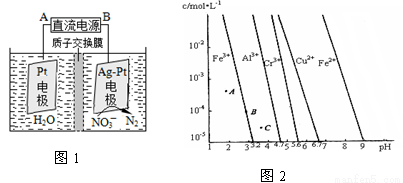
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:选择题
在下列各溶液中,离子一定能大量共存的是:
A.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.无色溶液中:K+、Na+、MnO4-、SO42-
D.室温下,pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届广东省高三9月月考化学试卷(解析版) 题型:选择题
下列关于有机物的说法错误的是( )
A.由CH2=CHCOOCH3合成的聚合物为
B.溴乙烷与NaOH乙醇溶液共热生成乙烯
C.装饰材料中的甲醛和芳香烃会造成居室污染
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源:2015届江西南昌三中高三11月份月考化学试卷(解析版) 题型:选择题
(8分)2013年以来全国各地都遭遇“十面霾伏”。其中,二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分。综合治理其污染是环境化学当前的重要研究内容。
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示:
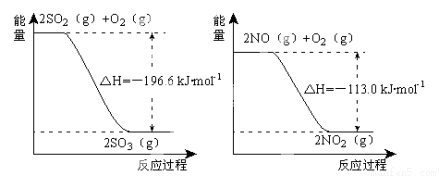
则NO2氧化SO2的热化学方程式为 _____________________________ 。
(2)SO2与O2反应时的平衡转化率与温度、压强的关系如图所示。根据图示回答下列问题:

①压强:Pl P2(填“>”、“=”或“<”)。
②平衡常数:A点 B点(填“>”、“=”或“<”)。
③200℃下,将一定量的SO2和O2充人体积为1 L的密闭容器中,经10min后测得容器中各物质的物质的量如下表所示:
气体 | SO2 | O2 | SO3 |
物质的量(mol) | 1.6 | 1.8 | 0.4 |
10min内该反应的反应速率v(O2)= ;该反应达到化学平衡状态的标志是 。
a.SO2和O2的体积比保持不变 b.体系的压强保持不变
c.混合气体的密度保持不变 d.SO2和SO3物质的量之和保持不变
(3)用NH3催化还原NOx可以消除氮氧化物的污染。
①写出氨气消除NO污染的化学方程式 ___________________________ ;
②若还原产物比氧化产物多0.5mol,则反应转移电子数为 ________ 。
查看答案和解析>>
科目:高中化学 来源:2015届江西南昌三中高三11月份月考化学试卷(解析版) 题型:选择题
在25°C,101kPa下,由HCHO(g)、H2和CO组成的混合气体共6.72g,其相对氢气的密度为14,将该气体与2.24L氧气(标态)充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为
A.等于6.72g B.小于6.72g C.大于6.72g D.无法计算
查看答案和解析>>
科目:高中化学 来源:2015届江苏连云港市高三上第一次月考化学试卷(解析版) 题型:选择题
在某100mL混合酸中,硝酸物质的量浓度为0.4mol/L,硫酸物质的量浓度为0.2mol/L,向其中加入3.2g铜粉,微热,待其充分反应后,溶液中铜离子的物质的量浓度约为
A.0. 15mol/L B.0.3mol/L C.0.5mol/L D.无法计算
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高二上期中化学试卷(必修)(解析版) 题型:选择题
欲将蛋白质从水中析出而又不改变它的性质应加入
A、甲醛溶液 B、饱和Na2SO4溶液 C、CuSO4溶液 D、浓硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com