
| A. | 1molCu与足量的S反应转移电子数为2NA | |
| B. | 46g有机物C2H6O中含有共价键的数目为7NA | |
| C. | 在0.5L2mol•L-1的Na2CO3溶液中含CO32-的数目为NA | |
| D. | 10gD2O和H218O的混合物中含有的中子数为5NA |
分析 A.铜与硫反应生成硫化亚铜;
B.依据n=$\frac{m}{M}$计算物质的量,结合有机物C2H6O存在同分异构体分析;
C.碳酸根离子为弱酸根离子,部分发生水解;
D.质量转化为物质的量,结合1个D2O和H218O中都含有10个中子解答.
解答 解:A.1molCu与足量的S反应生成0.5mol硫化亚铜,转移电子数为NA,故A错误;
B.依据n=$\frac{m}{M}$计算物质的量=$\frac{46g}{46g/mol}$=1mol,有机物C2H6O存在同分异构体,若为乙醇含有极性键的数目一定为7NA,若为甲醚含有极性键的数目一定为8NA,故B错误;
C.碳酸根离子为弱酸根离子,部分发生水解,在0.5L2mol•L-1的Na2CO3溶液中含CO32-的数目小于NA,故C错误;
D.10gD2O和H218O的混合物物质的量为$\frac{10g}{10g/mol}$=0.5mol,含有的中子物质的量为0.5mol×10=5mol,个数为5NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意碳酸根离子的水解,注意铜与弱氧化剂反应生成亚铜离子.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LCHCl3中含有碳氯键数目为0.3NA | |
| B. | 25℃时,0.1mol/L的Na2CO3溶液中含有Na+的数目为0.02NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 1molNa2O和1molNa2O2的混合物中,含有的离子总数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 塑料 | B. | 玻璃 | C. | 淀粉 | D. | 合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
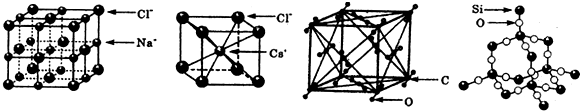
| A. | 干冰的晶胞中含有6个CO2分子 | |
| B. | 干冰是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 | |
| C. | 在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键 | |
| D. | 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.lmol/LCH3COONa溶液:c(Na+)═c(CH3COO-) | |
| B. | 0.1mol/LNa2CO3溶液:c(Na+)═c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| C. | 向醋酸钠溶液加适量醋酸所得溶液:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| D. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
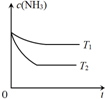 氨是一种重要的化工产品.
氨是一种重要的化工产品.| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Kap(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.8×10-20 | 白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
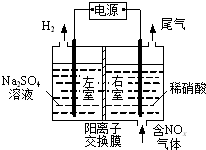 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲醛的电子式: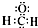 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: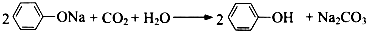 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com