
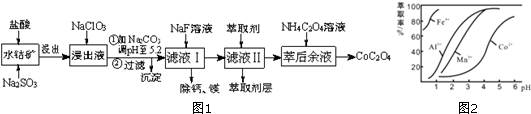
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
分析 含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴,
(1)亚硫酸钠具有还原性,能还原氧化性离子;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水;
(3)Fe3+、Al3+水解导致溶液呈酸性,碳酸根离子和氢离子反应,从而促进水解平衡向右移动;
(4)滤液Ⅱ中加入萃取剂的作用是除去锰离子;根据图知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(5)当加入过量NaF后,所得滤液中$\frac{c(Mg{\;}^{2+})}{c(Ca{\;}^{2+})}$=$\frac{\frac{Ksp(MgF{\;}_{2})}{c(F{\;}^{-}){\;}^{2}}}{\frac{Ksp(CaF{\;}_{2})}{c(F{\;}^{-}){\;}^{2}}}$=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$,据此计算;
解答 解:含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴,
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,反应的离子方程式为SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ 或SO32-+2 Co3++H2O═SO42-+2Co2++2H+,
故答案为:Fe3+、Co3+;SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ 或SO32-+2 Co3++H2O═SO42-+2Co2++2H+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O?R(OH)3+3H+,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀,
故答案为:R3++3H2O?R(OH)3+3H+,加入碳酸钠后,H+与CO32-反应,使水解平衡右移,从而产生沉淀;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(5)当加入过量NaF后,所得滤液中$\frac{c(Mg{\;}^{2+})}{c(Ca{\;}^{2+})}$=$\frac{\frac{Ksp(MgF{\;}_{2})}{c(F{\;}^{-}){\;}^{2}}}{\frac{Ksp(CaF{\;}_{2})}{c(F{\;}^{-}){\;}^{2}}}$=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7,
故答案为:0.7.
点评 本题考查物质分离和提纯,为高频考点,涉及溶度积常数计算、沉淀与pH的关系、盐类水解、氧化还原反应等知识点,明确实验原理是解本题关键,知道涉及的操作方法及发生的反应,难点是溶度积常数计算,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. |  分散系的分类 | B. |  稀释浓硫酸的过程 | ||
| C. |  向碳酸钠溶液中逐滴滴入盐酸 | D. |  比较Na2CO3、NaHCO3的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
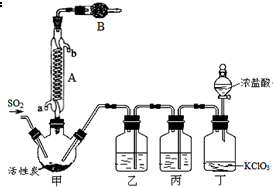 硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等.有关物质的部分性质如表:| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取溴苯:将铁屑、溴水、苯混合加热 | |
| B. | 实验室制硝基苯:先加入苯,再加浓硫酸,最后滴入浓硝酸 | |
| C. | 提取溶解在水中的少量碘:加入CCl4振荡、静置、分层后取出有机层再分离 | |
| D. | 检验某溶液中是否含有甲醛:在盛有2mL10%CuSO4溶液的试管中滴加0.5mL10%NaOH溶液,混合均匀,滴入待检液,加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属阳离子与自由电子间的作用较弱 | |
| B. | 金属在外加电场作用下可失去电子 | |
| C. | 金属阳离子在外加电场作用下可发生定向移动 | |
| D. | 自由电子在外加电场作用下可发生定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCO3-一定不能大量存在 | B. | pH一定是12 | ||
| C. | 加入铝片一定能产生氢气 | D. | 一定不是NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气是一种有刺激性气味的气体 | B. | 氯气,液氯,氯水是同一种物质 | ||
| C. | 氯气能溶于水 | D. | 氯气是一种有毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| B. | 向某溶液中加入烧碱溶液,加热,用湿润红色石蕊试纸检验,石蕊试纸变蓝色,该溶液中一定含有NH4+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 向某溶液中加入硝酸酸化的硝酸银溶液,有白色沉淀生成,该溶液中一定含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com