

分析 由元素在周期表中位置,可知P为氢、A为碳、B为氮、C为O、D为F、E为Ne、F为Mg、G为Al、H为Si、I为Cr、J为Fe、K为Cu、Q为Ga、L为Rb、N为At.
(1)I为Cr,价电子排布式为3d54s1,K为Cu;
(2)J为Fe,N为At,根据核外电子排布规律书写,简化电子排布式中用稀有气体原子符号并用[]括起代替相应内层排布;
(3)a.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
b.同周期自左而右第一电离能呈增大趋势,但IIA族、VA元素的第一电离能高于同周期相邻元素的;
c.同周期自左而右电负性增大、同主族自上而下电负性减小;
d.元素非金属性越强,最高价含氧酸的酸性越强;
(4)a.由L的位置可知,L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.由O的位置可知,O位于元素周期表中第七周期Ⅷ族,属于d区元素;
c.M位于IB族,外围电子排布式为5d106s1,属于ds区元素;
d.H处于IVA族,所在族的外围电子排布式为ns2np2,属于p区元素;
(5)由H、C、O三种元素形成的某化合物,对氢气的相对密度为15,则该化合物相对分子质量为30,故该化合物为HCHO,为平面三角形;
(6)非金属性越强,对应氢化物越稳定;
(7)K的常见离子为Cu2+、B的最简单氢化物为NH3,二者形成的[Cu(NH3)4]2+配离子,其水溶液呈深蓝色,Ag和元素K同族,且在K的下一周期,二者原子序数相差为第四周期容纳元素种数;Ag+也可以和NH3形成配离子,配位数为2,该配离子为[Ag(NH3)2]+.
解答 由元素在周期表中位置,可知P为氢、A为碳、B为氮、C为O、D为F、E为Ne、F为Mg、G为Al、H为Si、I为Cr、J为Fe、K为Cu、Q为Ga、L为Rb、N为At.
(1)I为Cr,价电子排布式为3d54s1,最高正化合价为+6,K为Cu,元素名称为铜,
故答案为:+6;铜;
(2)J为Fe,原子核外有26个电子,核外电子排布式为1s22s22p63s23p63d64s2,N为At,处于第六周期VIIA,简化电子排布式为[Xe]4f145d106s26p5,
故答案为:1s22s22p63s23p63d64s2;[Xe]4f145d106s26p5;
(3)a.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径G>H>A>B,故a错误;
b.同周期自左而右第一电离能呈增大趋势,但IIA族、VA元素的第一电离能高于同周期相邻元素的,故第一电离能E>D>B>C,故b错误;
c.同周期自左而右电负性增大、同主族自上而下电负性减小,故电负性A>H>G>Q,故c正确;
d.非金属性B>A>H>G,则最高价氧化物的水化物酸性B>A>H>G,故d正确,
故选:cd;
(4)a.由L的位置可知,L位于元素周期表中第五周期ⅠA族,属于s区元素,故a正确;
b.由O的位置可知,O位于元素周期表中第七周期Ⅷ族,属于d区元素,故b错误;
c.M位于IB族,外围电子排布式为5d106s1,属于ds区元素,故c错误;
d.H处于IVA族,所在族的外围电子排布式为ns2np2,属于p区元素,故d正确,
故选:bc;
(5)由H、C、O三种元素形成的某化合物,对氢气的相对密度为15,则该化合物相对分子质量为30,故该化合物为HCHO,为平面三角形,键角约是120°,
故答案为:120°;
(6)非金属性O>N,故氢化物稳定性:H2O>NH3,
故答案为:H2O;
(7)K的常见离子为Cu2+、B的最简单氢化物为NH3,二者形成的[Cu(NH3)4]2+配离子,名称为四氨合铜离子,其水溶液呈深蓝色,Ag和元素K同族,且在K的下一周期,二者原子序数相差为第四周期容纳元素种数,故Ag的原子序数为29+18=47;Ag+也可以和NH3形成配离子,配位数为2,该配离子为[Ag(NH3)2]+.
故答案为:四氨合铜离子;深蓝色;47;[Ag(NH3)2]+.
点评 本题是对物质结构的考查,涉及元素周期表结构、核外电子排布、元素周期律、分子结构、配合物等,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
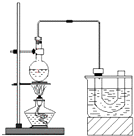 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等.请回答下列问题: ,存在的化学键类型有非极性键和极性键.
,存在的化学键类型有非极性键和极性键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属元素中,金属活泼性最强的是Li | |
| B. | 第三周期元素中,原子半径最大的是Cl | |
| C. | 短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4 | |
| D. | 原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羰基硫中O为-2价,C、S都是+1价 | |
| B. | 羰基硫分子中共含有3个原子核、16个电子 | |
| C. | 羰基硫分子结构中只含有极性共价键 | |
| D. | 羰基硫的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{M}{10s•ρ}$mol/L | B. | $\frac{1000s•ρ}{M(100+s)}$mol/L | ||
| C. | $\frac{10s•ρ}{M}$mol/L | D. | $\frac{M(100+s)}{1000s•ρ}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com